



摘要:近日,清华大学化学系刘凯教授/张洪杰院士团队联合中国科学院大学苏娟娟副教授、中国人民解放军第七医学中心苗莉主任等团队在SPDT治疗领域取得新进展,提出了一种基于超声触发生物发光以增强SPDT效应的创新策略。该团队成功开发出一种力响应生物发光蛋白系统,有效克服了传统光动力治疗中组织穿透深度不足的局限,为深部肿瘤的精准治疗提供了新途径。如图1所示,研究团队通过将机械敏感通道蛋白(MscL)与水母发光蛋白(AEQ)相结合,构建出一种新型力响应生物发光蛋白复合体。在自由场超声刺激下,MscL通道响应机械力打开并诱导钙离子内流,进而激活AEQ产生生物发光,实现了无需外部光源的原位光激活。
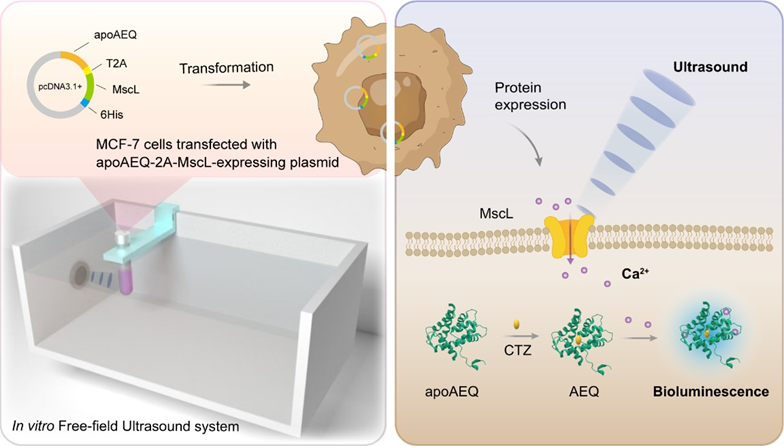
图1. 力响应生物发光蛋白系统设计示意图
背景介绍:
声光动力疗法(SPDT)融合了声动力(SDT)与光动力(PDT)两种治疗模式的优势,在恶性肿瘤的微创治疗领域展现出显著的应用潜力。该策略通过联合超声与光对敏化剂进行协同激活,不仅可大幅提升活性氧(ROS)的生成效率,还能在降低用药剂量的同时发挥“1+1>2”的抗肿瘤协同效应。然而,由于光在生物组织中的穿透深度有限,依赖外部光源激发的光动力作用难以有效覆盖深部肿瘤区域,这一局限不仅影响整体疗效,也可能因浅表能量过量沉积而引起周围正常组织的光损伤。因此,发展一种能够实现高效、可控的在体发光新技术,已成为突破SPDT治疗瓶颈的关键研究方向。
本文亮点:
实验结果表明,AEQ所产生的生物发光具备足够的光子能量,可有效激活天然声光敏剂二氢卟吩e6(Ce6),并诱导其生成具有细胞毒性的单线态氧(图2)。与此同时,超声刺激不仅触发生物发光,还可直接激活Ce6产生声毒性作用,从而通过声动力与光动力机制的协同效应,显著提升细胞内活性氧(ROS)水平,并强烈诱导肿瘤细胞凋亡。
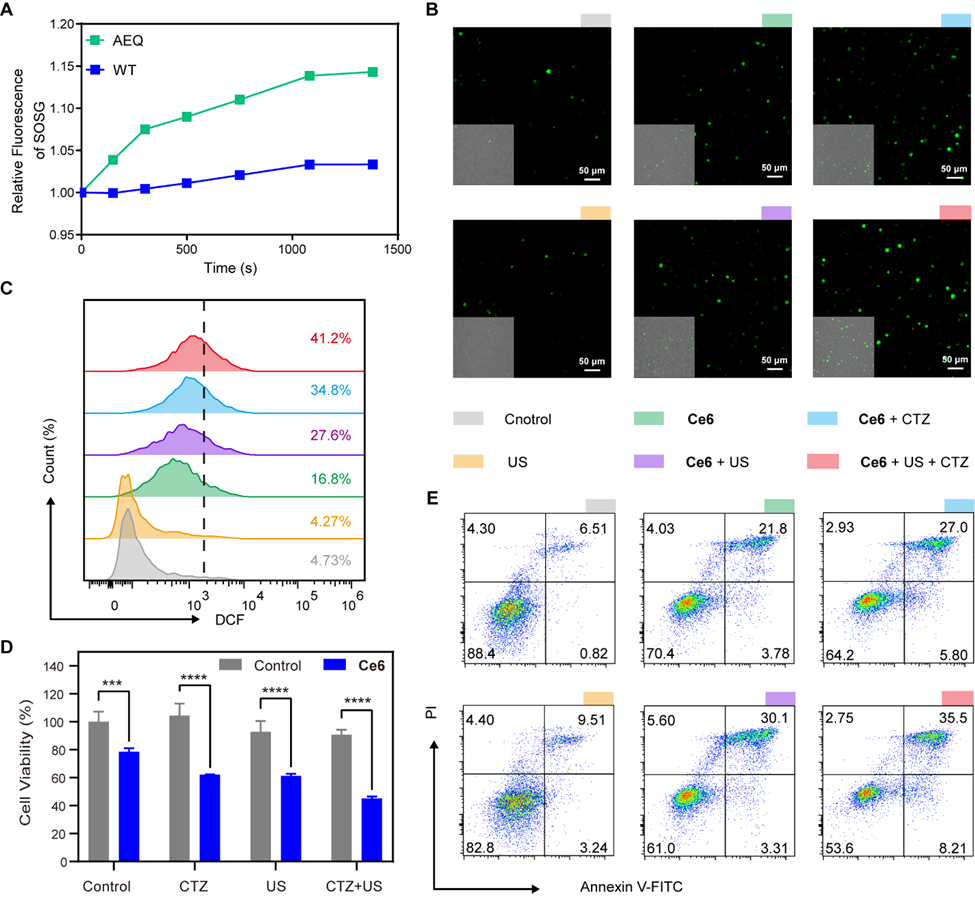
图2. 超声触发生物发光诱导体外声/光细胞毒性
进一步构建了声致发光纳米粒(SNLP),用于共同递送Ce6和发光底物腔肠素400a(CTZ),以增强生物发光在体内的可控性与治疗应用(图3)。在超声刺激下,SNLP可诱导已转染力响应生物发光蛋白的肿瘤细胞发生免疫原性细胞死亡(ICD),并释放ATP、CRT等损伤相关分子模式(DAMPs),进而促进树突状细胞(DCs)的成熟与活化。该结果充分表明,超声触发的生物发光SPDT不仅能直接杀伤肿瘤,还可有效激发系统性抗肿瘤免疫应答。
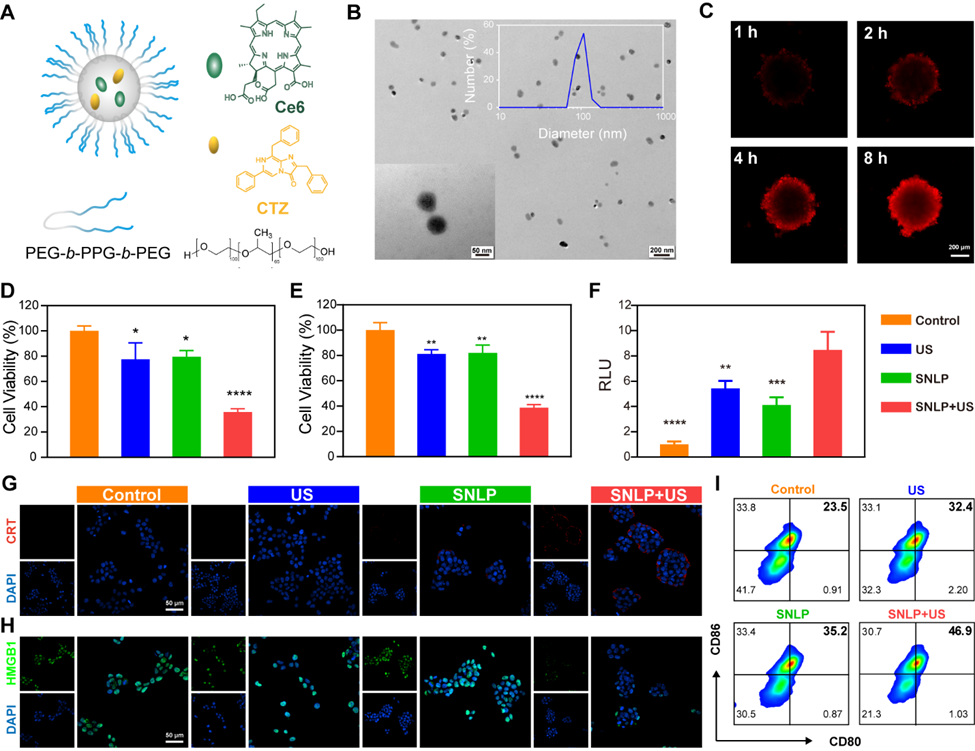
图3. SNLP介导SPDT的ICD效应
为实现体内精准治疗,研究团队开发了一套专用超声设备(Adv. Mater. 2025, 37, 2410559),将自由场超声系统成功应用于体内环境。该设备通过精准控制低强度超声,触发经慢病毒(LV)转染并表达力响应生物发光蛋白的肿瘤细胞发生持续性钙内流,进而激活富集于肿瘤部位的SNLPs纳米颗粒,产生声光动力协同治疗效应,显著抑制原发性肿瘤生长并减少肺转移。并有效促进CD4+和CD8+ T细胞在肿瘤组织中的浸润,增强对肿瘤再生的抵抗能力。流式细胞分析显示,治疗后小鼠脾脏内效应记忆T细胞(TEM)亚群显著扩增,表明该疗法不仅能抑制原发肿瘤,还可诱发强大而持久的抗肿瘤免疫记忆,从而显著改善远期治疗预后(图4)。
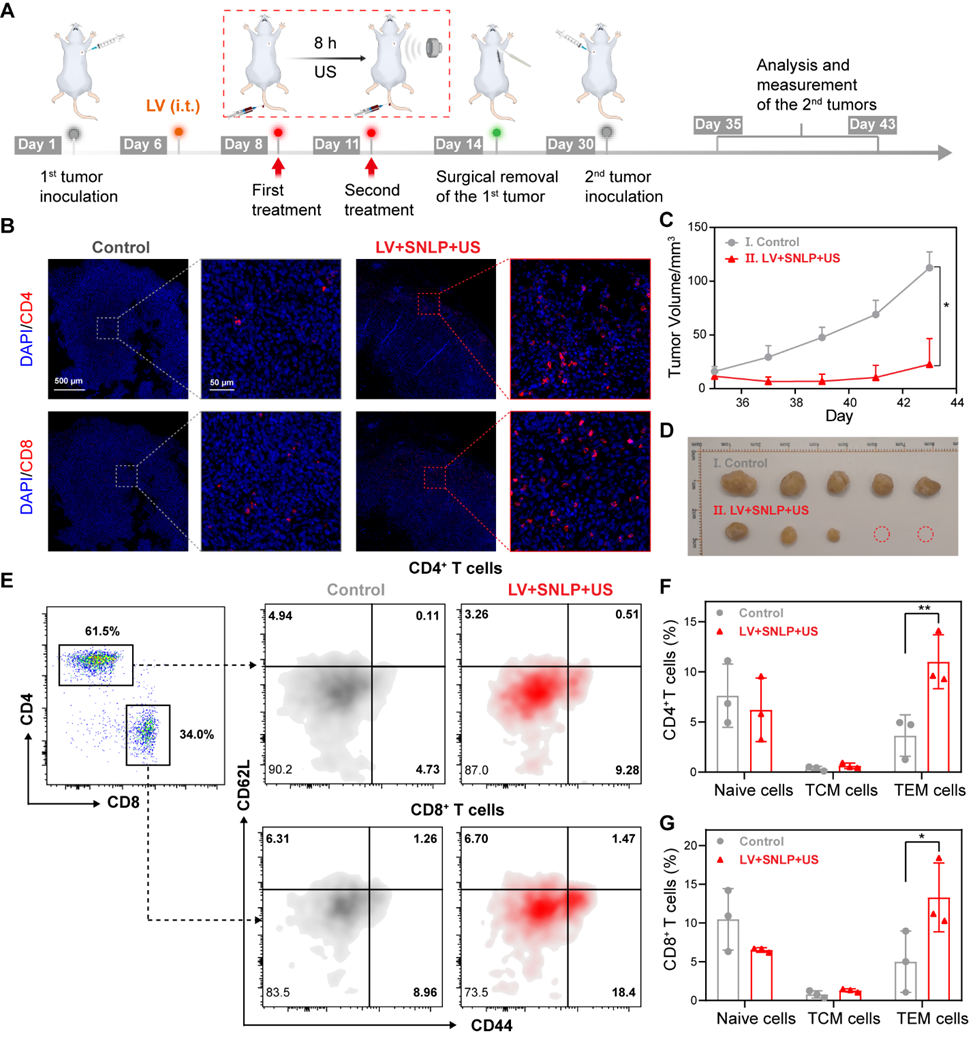
图4. 超声触发生物发光介导SPDT治疗诱导免疫记忆
总结与展望:
本研究提出了一种基于超声触发生物发光介导SPDT的新策略,利用机械响应生物发光蛋白系统突破传统光动力疗法的穿透限制,实现深部组织精准治疗。同时整合声/光动力协同效应,显著增强抗肿瘤免疫并诱导长效免疫记忆,其独特的"声-光-免疫"三联作用机制在治疗效果、免疫原性和时空控制方面均优于单一疗法,为复发性肿瘤治疗提供了具有重要临床转化潜力的创新方案。
文章详情:
In Situ Ultrasound-Triggered Bioluminescence for Combined Sono/Photodynamic Immunotherapy
Liu Wang, Yangyi Liu, Jing Sun, Juanjuan Su*, Jing Feng, Li Miao*, Weijie Zhao, Hongjie Zhang, Kai Liu*
Cite this by DOI: 10.1021/acsnano.5c06999
文章链接:https://doi.org/10.1021/acsnano.5c06999