



摘要:中国科学院长春应用化学研究所王樱蕙团队开发了一种基于压电效应增强的铁基单原子纳米酶(BFTM),通过超声驱动产生压电电荷,辅助单原子铁位点高效产生活性氧(ROS),触发焦亡。同时,BFTM共载三苯基膦(TPP)和甲基(Z)-4-(氯(2-苯基肼基)甲基)苯甲酸(MMB,一种琥珀酸的生物正交试剂),通过生物正交反应消耗细胞内琥珀酸,增强焦亡并恢复T淋巴细胞活性,显著增强抗肿瘤免疫治疗效果。
背景介绍:
癌症免疫治疗是近年来最重要的医学成就之一,但肿瘤细胞的低免疫原性和复杂的免疫抑制肿瘤微环境(TME)严重限制了其疗效。细胞焦亡(Pyroptosis)作为一种新的免疫治疗手段,能够触发强烈的免疫原性细胞死亡(ICD),重塑免疫抑制的TME。然而,肿瘤微环境中的琥珀酸代谢紊乱会显著降低焦亡率,并使T淋巴细胞功能失调。因此,开发能够安全、有效地触发焦亡并调节琥珀酸代谢的新型免疫治疗策略具有重要意义。
本文亮点:
压电效应增强:利用超声驱动的压电材料(钛酸钡,BTO)产生动态电场,显著增强单原子铁位点的过氧化氢酶(POD)活性,提高ROS生成效率。
生物正交反应:通过MMB与琥珀酸的生物正交反应,消耗细胞内琥珀酸,防止其对焦亡关键蛋白GSDMD的琥珀化修饰,增强焦亡效果。
免疫激活:BFTM不仅通过焦亡释放肿瘤抗原激活免疫反应,还通过重塑TME和恢复T细胞功能,增强系统性免疫应答。
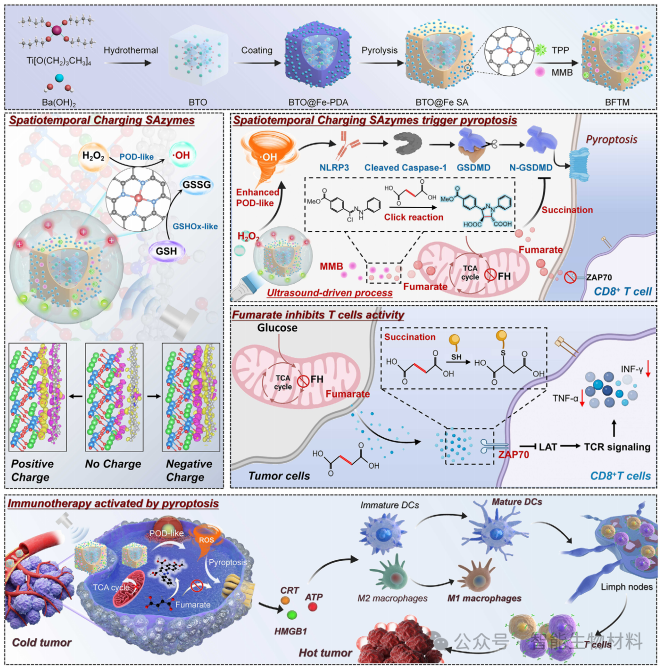
图1. 展示了BFTM的设计原理和作用机制。BFTM通过超声驱动的压电效应增强单原子铁位点的活性,产生活性氧(ROS),触发焦亡,并通过生物正交反应消耗琥珀酸,增强免疫治疗效果
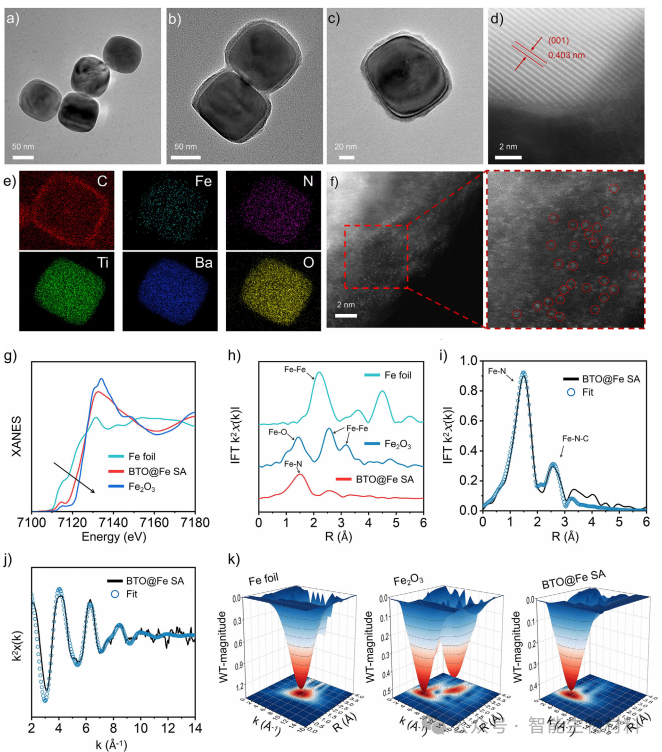
图2. 通过透射电子显微镜(TEM)和X射线吸收光谱(XAS)等技术,验证了BFTM的单原子结构和压电特性。实验结果表明,BFTM中的铁原子以单原子形式存在,并且压电效应显著增强了其催化活性
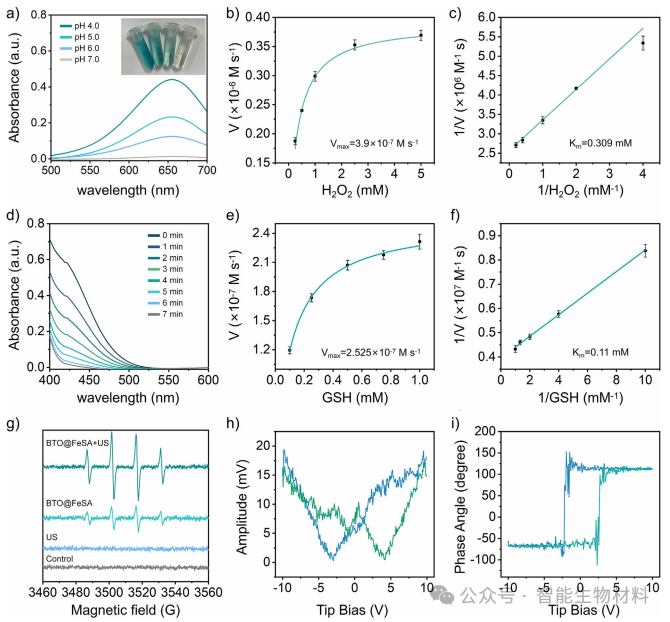
图3. 通过细胞实验,验证了BFTM在模拟肿瘤微环境条件下产生活性氧的能力及其对肿瘤细胞的杀伤效果。实验结果表明,超声驱动的BFTM能够显著增强ROS生成,诱导焦亡,并通过生物正交反应消耗琥珀酸,进一步增强焦亡效果
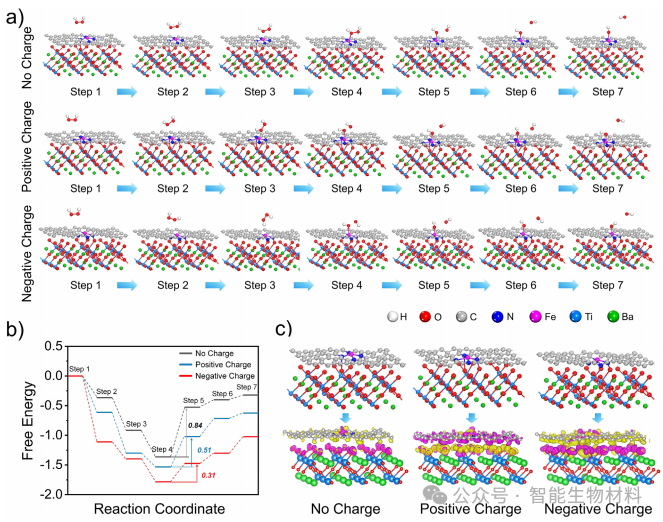
图4. 通过密度泛函理论(DFT)计算,揭示了压电电荷对单原子铁位点催化活性的影响机制。计算结果表明,正负电荷均能降低H₂O₂分解的能量障碍,显著增强BFTM的POD活性
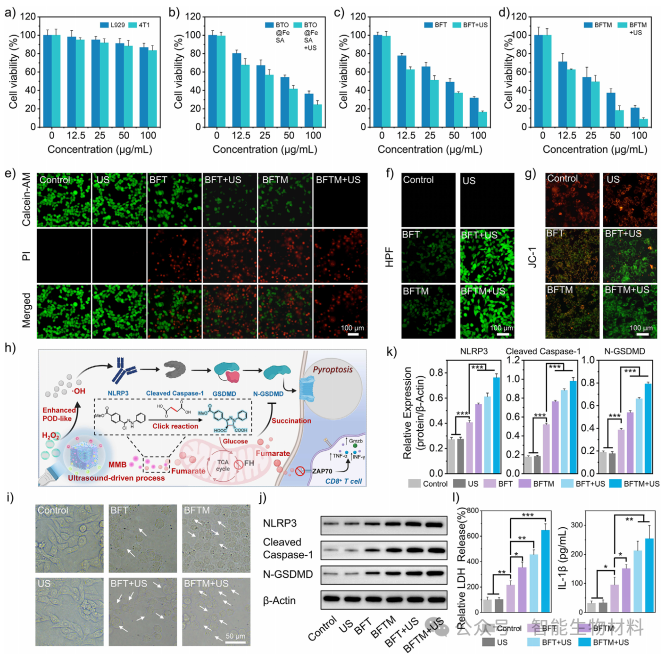
图5. 通过细胞实验,进一步验证了BFTM对肿瘤细胞焦亡的诱导作用及其对T细胞活性的恢复效果。实验结果表明,BFTM能够显著增强肿瘤细胞的免疫原性,激活树突状细胞(DCs),重塑免疫抑制的TME,并恢复T细胞的活性
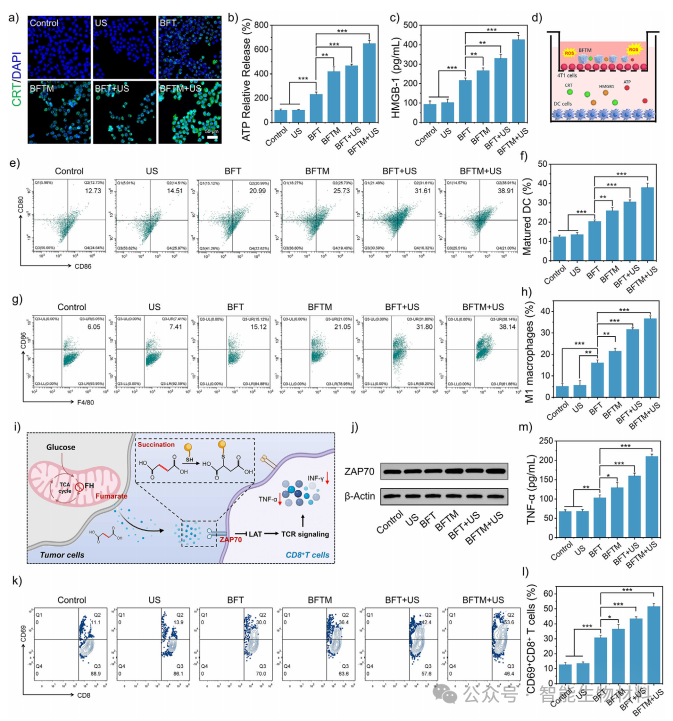
图6. 通过动物实验,验证了BFTM在体内抗肿瘤免疫治疗中的效果。实验结果表明,超声驱动的BFTM能够显著抑制肿瘤生长,延长小鼠生存时间,并通过激活系统性免疫反应,实现对远端肿瘤的抑制效果
总结与展望:
作者开发了一种基于压电效应增强的铁基单原子纳米酶(BFTM),通过超声驱动产生压电电荷,显著增强了单原子铁位点的过氧化氢酶(POD)活性,高效产生活性氧(ROS)以触发焦亡。同时,BFTM通过生物正交反应消耗细胞内琥珀酸,防止其对焦亡关键蛋白GSDMD的琥珀化修饰,进一步增强焦亡效果并恢复T淋巴细胞活性。这种策略不仅提高了肿瘤细胞的免疫原性,还重塑了免疫抑制的肿瘤微环境(TME),显著增强了抗肿瘤免疫治疗效果。未来,BFTM有望进一步优化,以提高其在体内的稳定性和生物相容性。例如,通过改进材料设计和表面修饰,可以延长BFTM在体内的循环时间,减少免疫原性。此外,结合更多的生物标志物和免疫检查点抑制剂,BFTM可以为更广泛的癌症类型提供更全面的治疗方案。随着技术的不断进步,这种基于压电效应和生物正交反应的纳米酶有望成为未来癌症免疫治疗的重要工具,为患者提供更有效的治疗选择。
文章详情:
Spatiotemporal Charging Single-Atom Nanozymes Activated Pyroptosis for Antitumor Immunotherapy via Bioorthogonal Disruption of Succination and Reinvigorating T Lymphocytes
Rui Niu, Bin Zhang, Yang Liu, Bo Xu, Ruiping Deng, Shuyan Song, Kai Liu, Yinghui Wang*, Hongjie Zhang
Cite this by DOI: 10.1002/adma.202502940
文章链接:https://doi.org/10.1002/adma.202502940