



摘要:中国科学院长春应用化学研究所王樱蕙团队通过锰离子(Mn²⁺)、胆固醇氧化酶(CHOx)和丙酮酸氧化酶(POx)的生物矿化作用,负载肿瘤坏死因子超家族成员 14(LIGHT)并经胶质瘤细胞膜功能化修饰,开发出一种创新型免疫激活纳米调节剂(MnCP-LIGHT@GL),用于 GBM 的高效免疫治疗。具有双酶活性的 MnCP-LIGHT@GL 通过 Mn²⁺介导的类芬顿反应,成功触发了活性氧(ROS)依赖的半胱天冬酶 - 1(caspase-1)介导的焦亡,而内源性胆固醇和丙酮酸氧化产生的过氧化氢(H₂O₂)进一步增强了这一过程;同时,CHOx 和 POx 可破坏胆固醇代谢与沃伯格效应,减少 TME 内免疫抑制代谢物(胆固醇和乳酸)的积累。LIGHT 能够促进肿瘤血管正常化,诱导肿瘤相关高内皮微静脉(TA-HEVs)形成,并推动三级淋巴结构(TLS)新生,这些由 LIGHT 介导的结构改变与焦亡细胞释放的损伤相关分子模式(DAMPs)协同作用,共同促进免疫细胞向肿瘤部位浸润和激活,进而增强抗肿瘤免疫应答。这一研究通过免疫原性细胞死亡、代谢重编程与免疫放大的协同作用,建立了一种针对 GBM 免疫抑制性 TME 的新型治疗范式。
背景介绍:
胶质母细胞瘤(GBM)是中枢神经系统中最常见的恶性肿瘤,其免疫抑制性肿瘤微环境(TME)导致免疫治疗效果受限。GBM的TME特征包括代谢失调、免疫细胞浸润不足以及胆固醇和乳酸等免疫抑制代谢物的积累。此外,GBM的血管功能异常阻碍了免疫细胞的浸润,进一步削弱了免疫反应。因此,开发能够同时调节代谢、诱导免疫激活并改善血管功能的新型治疗方法是攻克GBM的关键。
本文亮点:
1. 多靶点协同作用:通过同时靶向胆固醇和丙酮酸代谢,有效减少了免疫抑制代谢物的积累,并增强了氧化应激。
2. 细胞焦亡诱导:利用Mn²⁺介导的芬顿反应,成功诱导了细胞焦亡,释放损伤相关分子模式(DAMPs),激活免疫反应。
3. 免疫微环境重塑:LIGHT的释放促进了肿瘤血管正常化和三级淋巴结构(TLS)的形成,显著增强了免疫细胞的浸润和功能。
4. 生物矿化纳米平台:创新性地利用生物矿化方法构建纳米平台,实现了药物的高效负载和靶向释放。
胶质瘤细胞膜功能化:通过胶质瘤细胞膜包覆,显著提高了纳米颗粒的血脑屏障穿透能力和肿瘤靶向性。
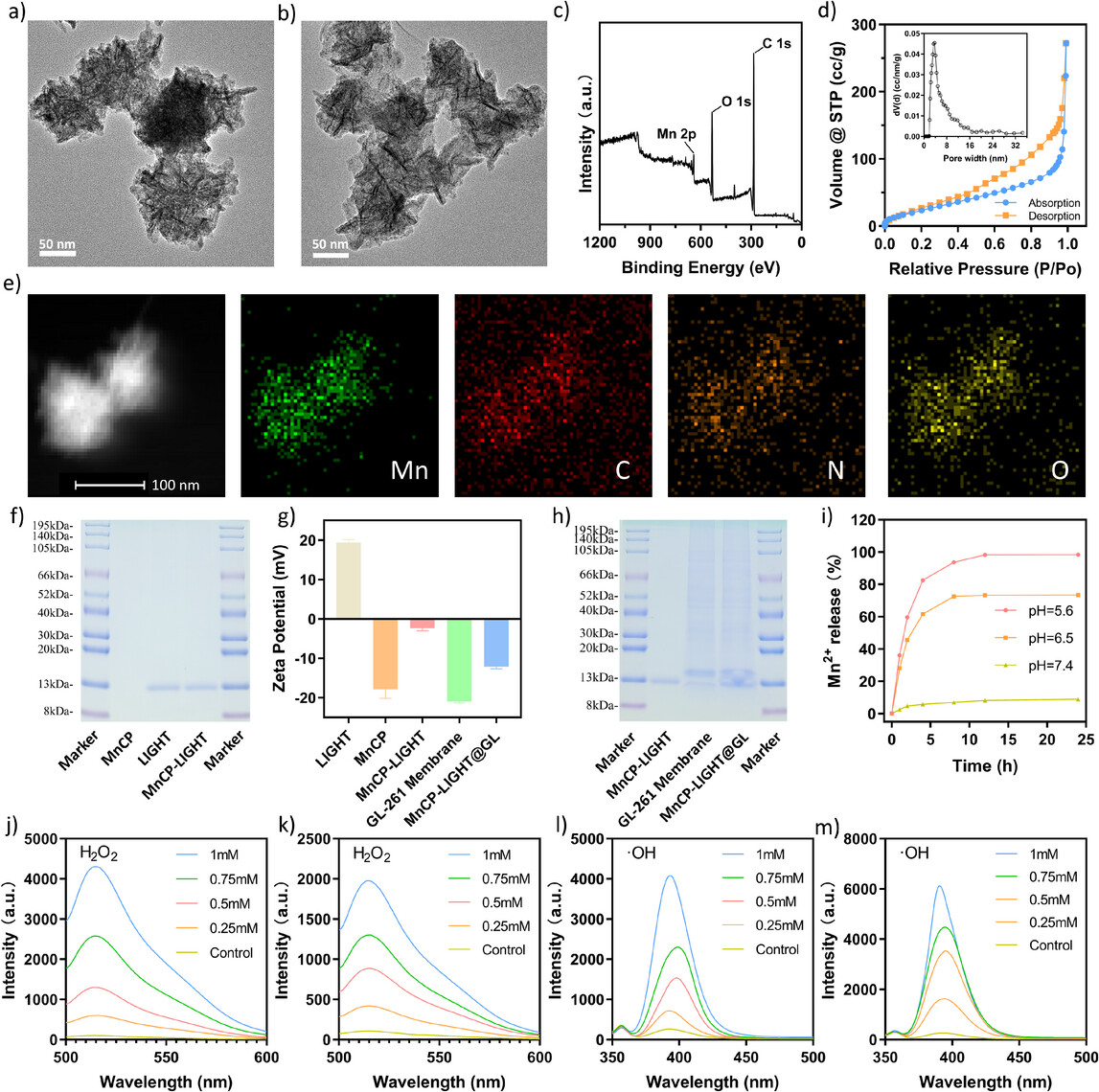
图1. 展示了MnCP-LIGHT@GL的合成与表征,包括纳米结构的形态、元素分布、酶活性验证以及细胞膜包覆后的尺寸和电位变化,确认了纳米平台的成功构建和功能化
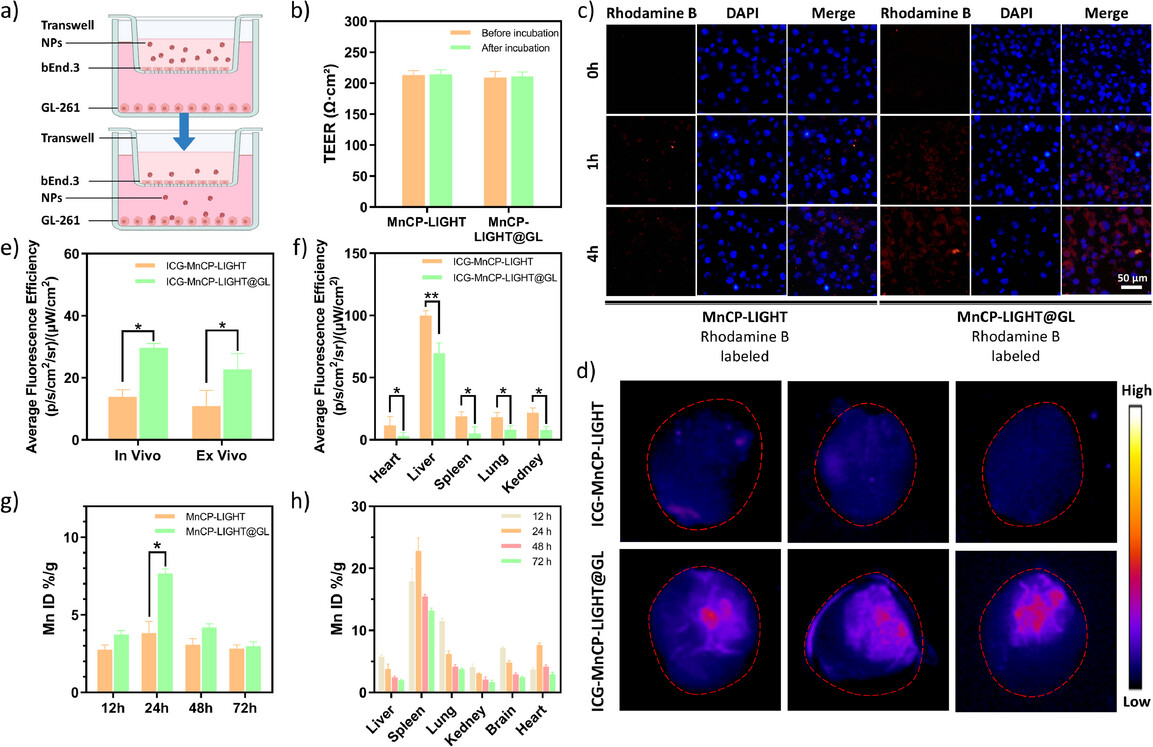
图2. 验证了MnCP-LIGHT@GL的血脑屏障穿透能力和对胶质瘤细胞的靶向性,通过体外模型和体内成像证明了其高效的BBB跨越和肿瘤富集能力
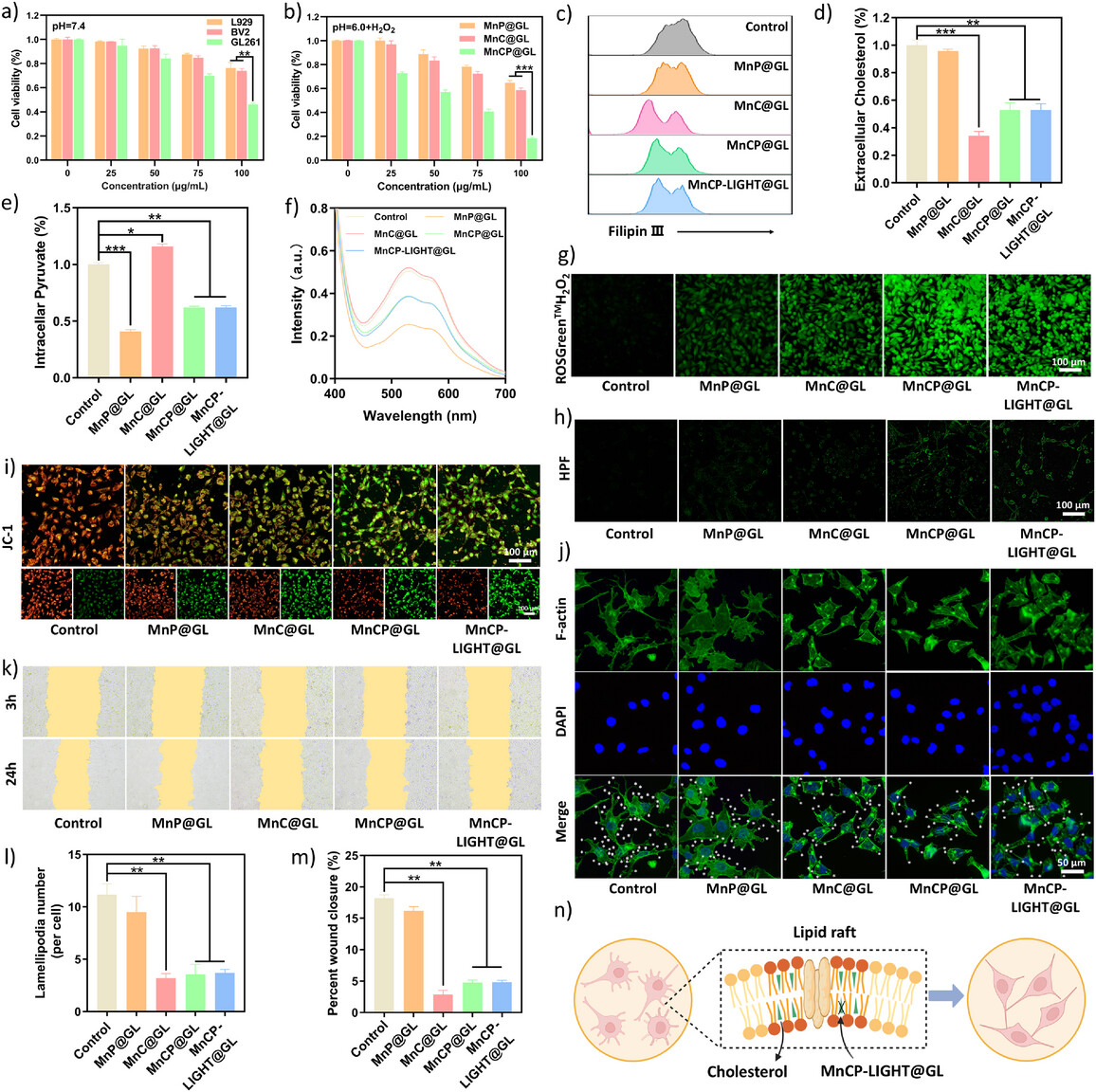
图3. 揭示了纳米调节剂对胆固醇和丙酮酸代谢的干扰,以及由此产生的氧化应激增强,表现为细胞内ROS水平上升和线粒体膜电位下降
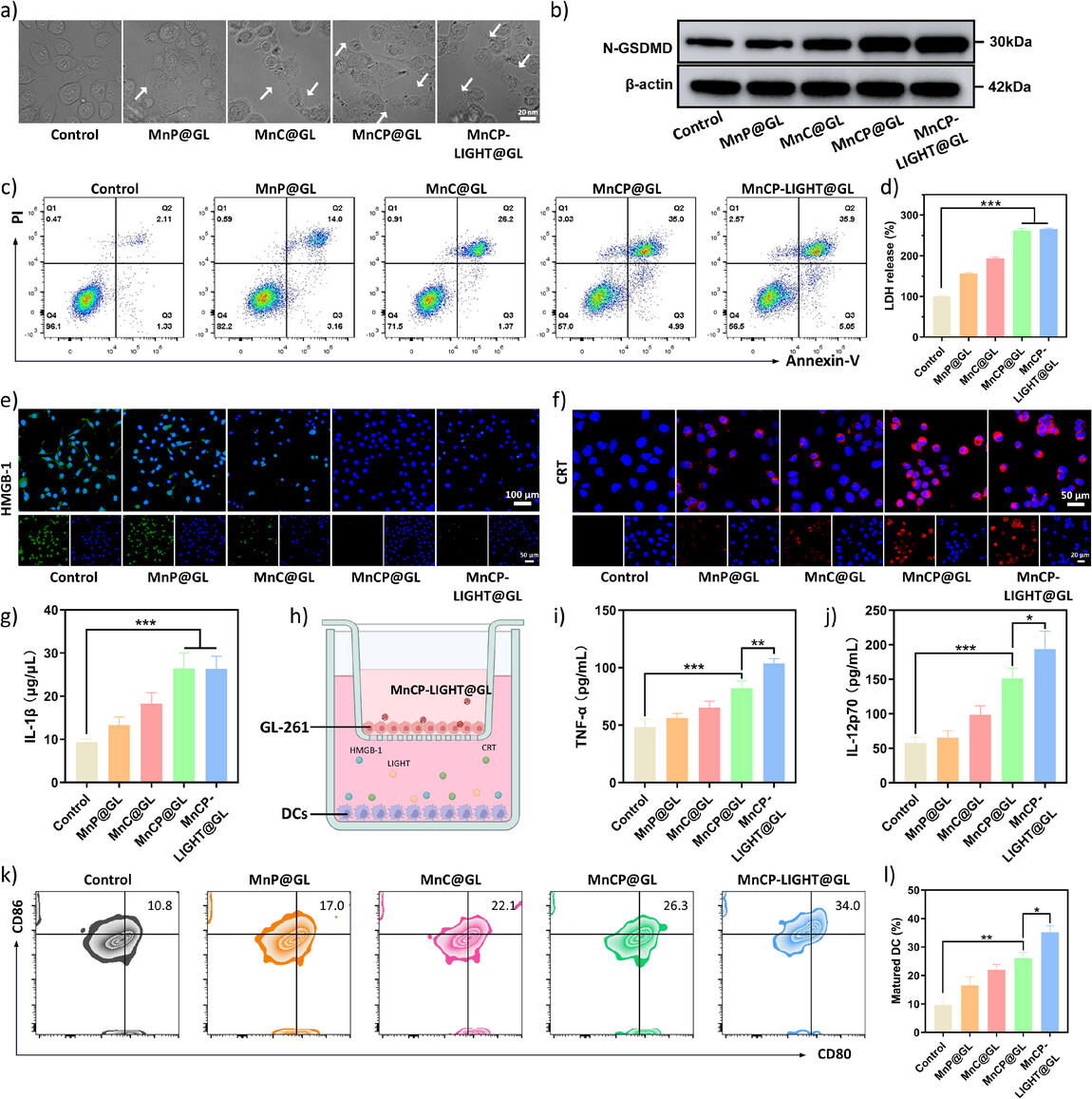
图4. 通过细胞形态学和标志物检测(如caspase-1、GSDMD、IL-1β)证实了细胞焦亡的发生,表明纳米调节剂成功诱导了免疫原性细胞死亡
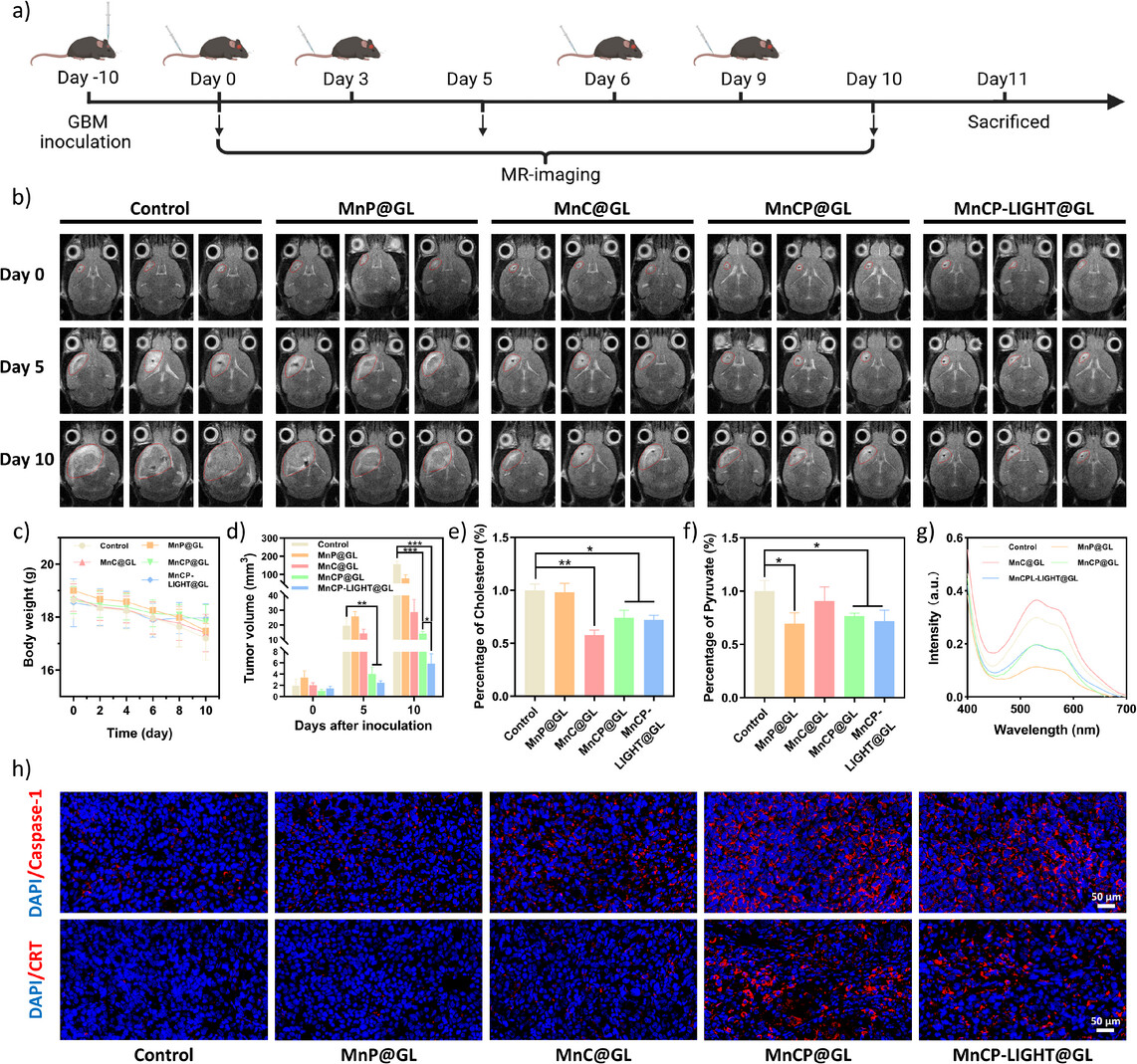
图5. 展示了MnCP-LIGHT@GL在体内模型中对肿瘤生长的抑制效果,通过MRI监测肿瘤体积变化,证明了其显著的抗肿瘤活性
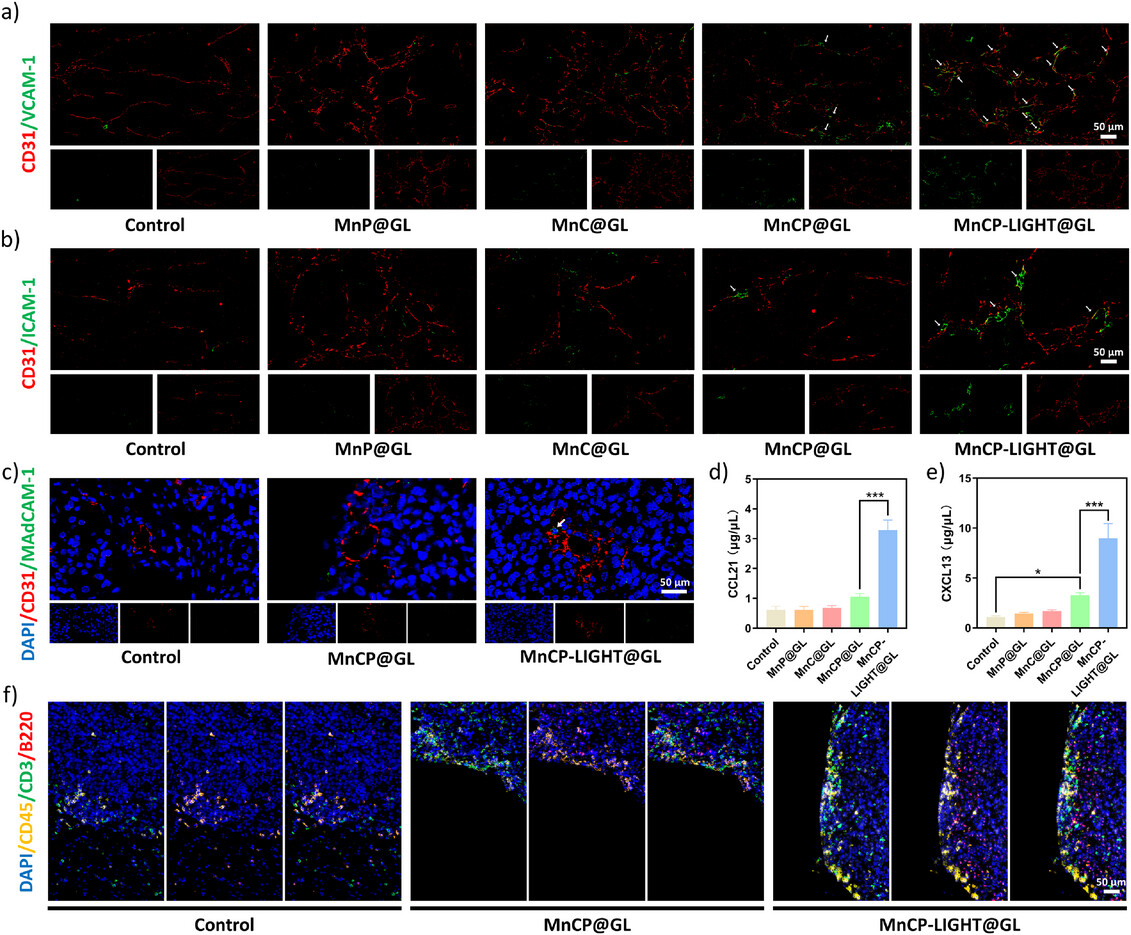
图6.揭示了纳米调节剂对肿瘤血管正常化和三级淋巴结构(TLS)形成的促进作用,表现为血管标志物表达上调和TLS区域的显著增加
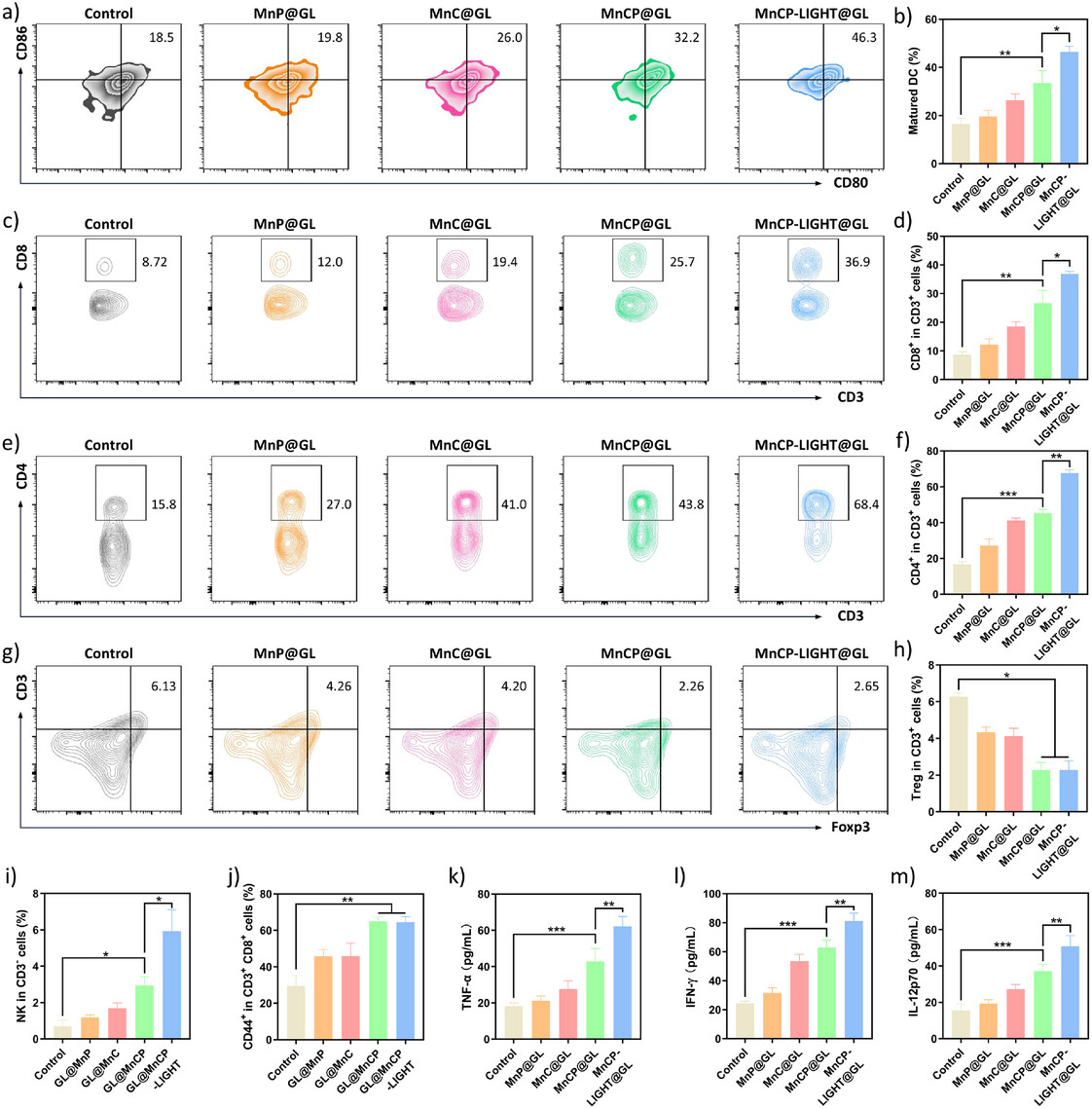
图7. 通过流式细胞术分析,展示了纳米调节剂对免疫细胞浸润的促进作用,包括DCs成熟、CD4⁺和CD8⁺ T细胞浸润增加,以及Tregs比例的降低,表明其重塑免疫微环境的能力
总结与展望:
作者成功开发了一种基于生物矿化的纳米调节剂(MnCP-LIGHT@GL),通过整合多种功能模块,实现了对胶质母细胞瘤(GBM)免疫抑制性肿瘤微环境的高效重塑。该纳米调节剂通过诱导细胞焦亡、代谢重编程和免疫激活的协同作用,显著增强了抗肿瘤免疫反应。实验结果表明,MnCP-LIGHT@GL能够有效穿透血脑屏障,靶向肿瘤细胞,并通过破坏胆固醇和丙酮酸代谢,减少免疫抑制代谢物的积累,同时增强氧化应激,诱导细胞焦亡并释放损伤相关分子模式(DAMPs)。此外,LIGHT的释放促进了肿瘤血管正常化和三级淋巴结构(TLS)的形成,显著提高了免疫细胞的浸润和功能激活。这些协同机制共同作用,打破了GBM的免疫抑制屏障,建立了有利于抗肿瘤免疫的微环境。展望未来,该研究为克服GBM对免疫疗法的抵抗性提供了全新的治疗范式。下一步研究可着眼于推动其临床转化,包括优化纳米颗粒的规模化生产工艺、开展大型动物模型的安全性及有效性评估,并探索其与其他免疫检查点抑制剂或放疗的联合治疗策略。此外,该“焦亡-代谢-免疫”级联激活平台的设计理念,也有望拓展至其他具有高度免疫抑制特性的实体瘤治疗中,为肿瘤免疫治疗领域提供普适性的技术借鉴。尽管前路仍需攻克诸如长期生物安全性、个体化给药方案等挑战,但这一研究无疑为下一代智能纳米免疫药物的开发奠定了坚实的基础,预示着代谢干预与免疫调控相结合的策略将在未来肿瘤治疗中扮演愈发重要的角色。
文章详情:
Biodegradable Nano-Regulator Reprograms Glioblastoma Immunosuppression: Pyroptosis-Metabolism-Immunity Crosstalk for Cascading Immune Activation
Donghao Qu, Yang Bai, Xinrui Liu, Yue Cao, Wanying Li, Ziqian Wang, Shiqi Bai, Shaopeng Zhang, Bin Wang, Shaokang Yang, Rui Niu*, Haifeng Wang*, Yunqian Li*, Yinghui Wang*, Hongjie Zhang
Cite this by DOI: 10.1002/anie.202516348
文章链接:https://doi.org/10.1002/anie.202516348