



摘要:近日,清华大学刘凯、中国科学院长春应用化学研究所刘亚伟、海军军医大学第三附属医院于勇、北京大学中日友好临床医学院孙伟团队研究构建了一种可注射的“双网络压电纳米陶瓷增强骨植入物”(NDNI),通过将快速固化的PMMA网络、类细胞外基质蛋白网络和压电KNN纳米陶瓷协同整合,使其力学性能(压缩强度≈140 MPa、弹性模量≈3.8 GPa)与天然皮质骨精准匹配,并在负重时由压电纳米颗粒产生成骨生物电信号,实现机械-生物电耦合调控。该植入物在体外显著促进骨髓间充质干细胞成骨分化和血管内皮细胞血管生成,在体内大鼠胫骨骨折模型中实现快速骨再生与近乎完全的步态功能恢复,为负重骨缺损修复提供了同时满足力学支撑、生物活性和电刺激的一体化策略。
背景介绍:
负重骨缺损修复长期受“力学失配”困扰:传统金属或陶瓷植入物因刚度过高产生应力屏蔽、抑制骨再生,而水凝胶等软材料虽具成骨活性却难以承受循环载荷,导致结构塌陷。现有3D打印多孔支架虽能调控力学性能,但预制形状难以贴合复杂缺损,且生物惰性表面缺乏促成骨微环境,因此亟需一种能同时实现“力学匹配-解剖贴合-主动成骨”的新型植入策略。
本文亮点:
研究团队通过基因工程表达富含赖氨酸的EGF融合蛋白,与氧化海藻酸钠在紫外照射下发生席夫碱交联,构建出模拟细胞外基质的蛋白网络;再将其与快速固化的PMMA网络互穿,并均匀分散10 wt%的KNN压电纳米陶瓷,6 min内原位固化成可注射的双网络复合植入物(NDNI)。
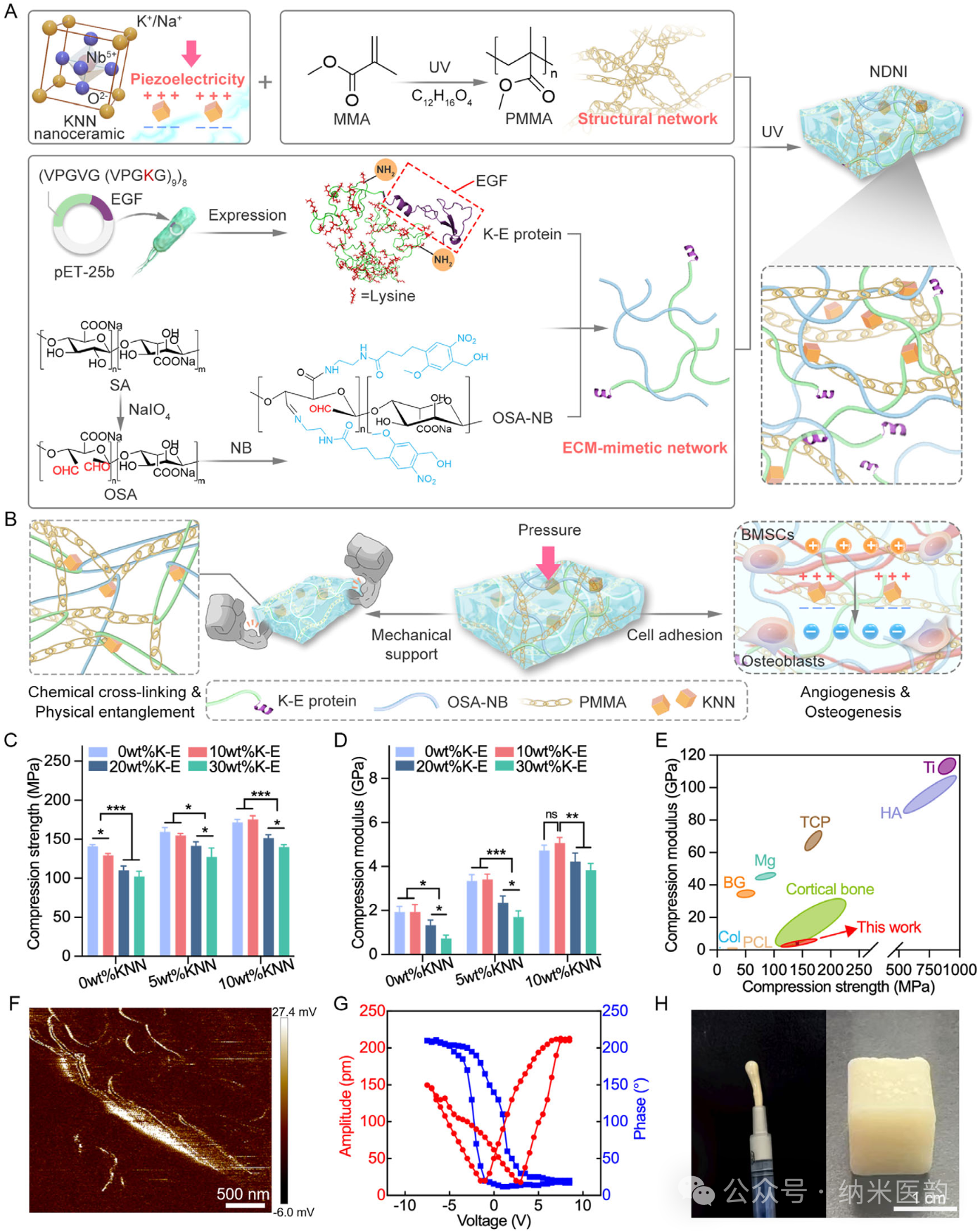
图1. 纳米颗粒增强双网络植入物(NDNI)的制备与表征。A) NDNI合成过程示意图。NDNI由PMMA、模拟ECM的蛋白网络以及生物压电KNN纳米陶瓷组成。B) 示意图显示NDNI可提供负重所需的力学支撑、模拟ECM的环境以促进细胞黏附与生长,并利用压电性能促进成骨。C,D) 不同K-E蛋白比例及KNN含量下NDNI的压缩强度和压缩模量。E) 天然皮质骨、NDNI及传统骨植入材料(胶原Col、聚己内酯PCL、生物玻璃BG、磷酸三钙TCP、镁Mg、钛Ti和羟基磷灰石HA 的压缩强度与模量比较。NDNI的压缩强度和模量最接近皮质骨,后者是负重骨的主要成分。F) 压电力显微镜获得的NDNI振幅图,证实其压电特性。G) NDNI的振幅-电压蝶形曲线及对应的相位滞后回线。H) NDNI可注射并可塑形成方形。
在体外,把NDNI与大鼠骨髓间充质干细胞(BMSCs)和人脐静脉内皮细胞(HUVECs)共培养,利用活/死染色、ALP/ARS染色、qRT-PCR、划痕及成管实验证实其优异的细胞相容性、促成骨和成血管能力;并通过Fluo-4 AM钙离子成像和流式细胞术揭示压电KNN在机械刺激下产生80–90 mV电信号,激活L-型钙通道—PI3K/AKT通路,显著增强细胞内钙振荡和成骨基因表达。

图2. NDNI的体外促血管生成能力。A) 划痕实验监测不同处理下HUVEC的迁移活性,空白虚线标记划痕边缘。B) Matrigel管腔形成实验的代表性图像,用于评估HUVEC的血管生成潜力。C,D) 使用ImageJ软件对不同处理下的连接点数和网格数进行定量分析。E,F) qRT-PCR分析HUVEC在3天后血管生成相关基因VEGF和CD31的表达。
在大鼠胫骨横断骨折模型中,将NDNI注入骨折间隙并以微型外固定支架稳定,术后12周Micro-CT、组织学(H&E、Masson)及免疫组化显示NDNI组新骨体积达39%,骨小梁厚度和数量显著优于CEMEX及空白对照,骨折线完全愈合;步态分析进一步证明其4周内恢复接近正常的行走功能,验证了该“机械-生物电”耦合策略在负重骨缺损修复中的高效性与安全性。
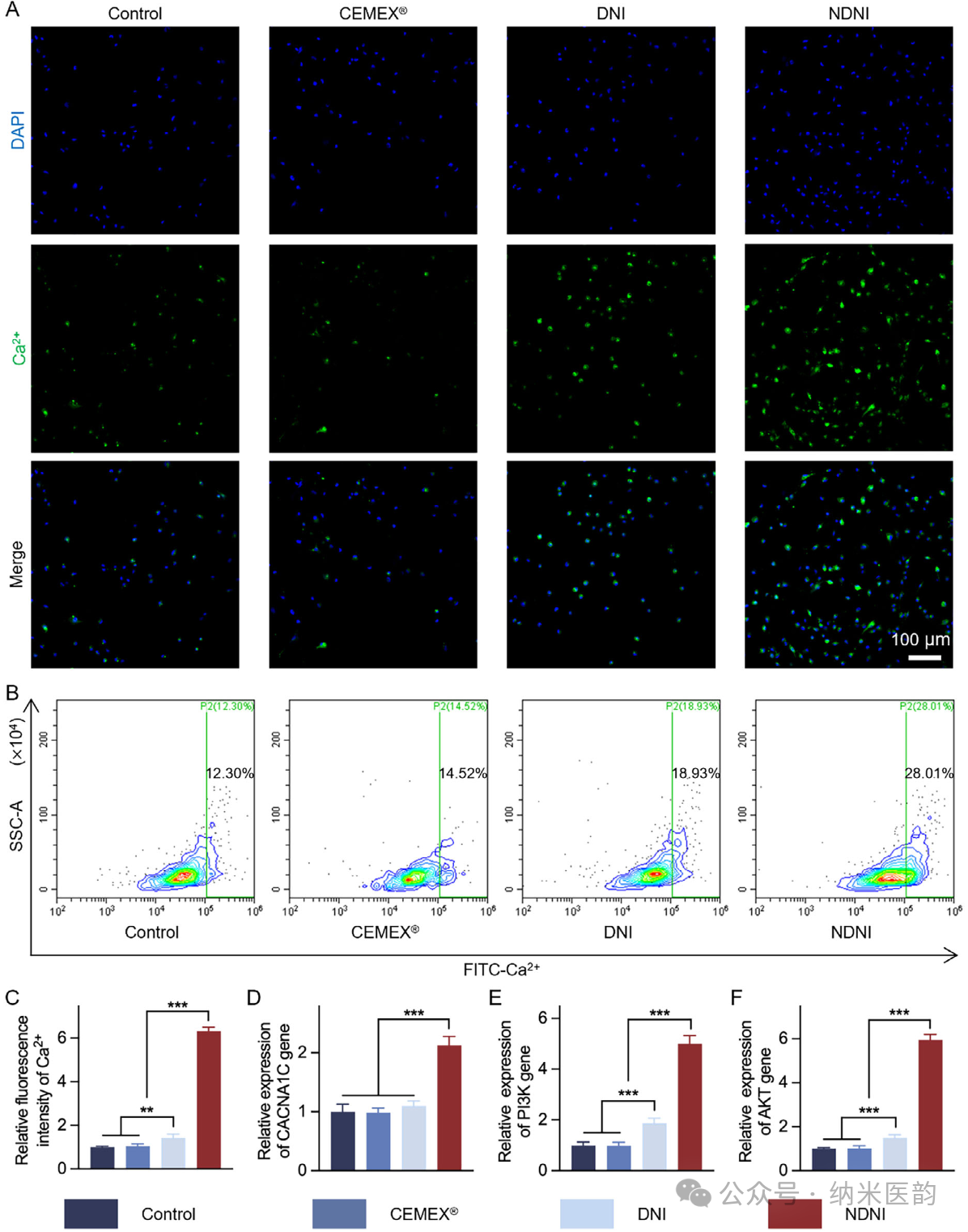
图3. NDNI体外调控Ca²⁺信号以促进成骨分化。A) 染色图像显示不同处理7天后的细胞内Ca²⁺水平(绿色:Ca²⁺;蓝色:细胞核)。B) 流式细胞术分析不同处理下FITC-Ca²⁺荧光强度,右上象限标注Ca²⁺阳性细胞百分比。C) 通过荧光强度分析对不同处理下细胞内Ca²⁺水平的定量分析。D) 处理7天后,细胞中钙通道相关基因CACNA1C的mRNA表达qRT-PCR分析。E,F) CACNA1C-PI3K-AKT轴下游基因PI3K(E)和AKT(F)的mRNA表达qRT-PCR分析。
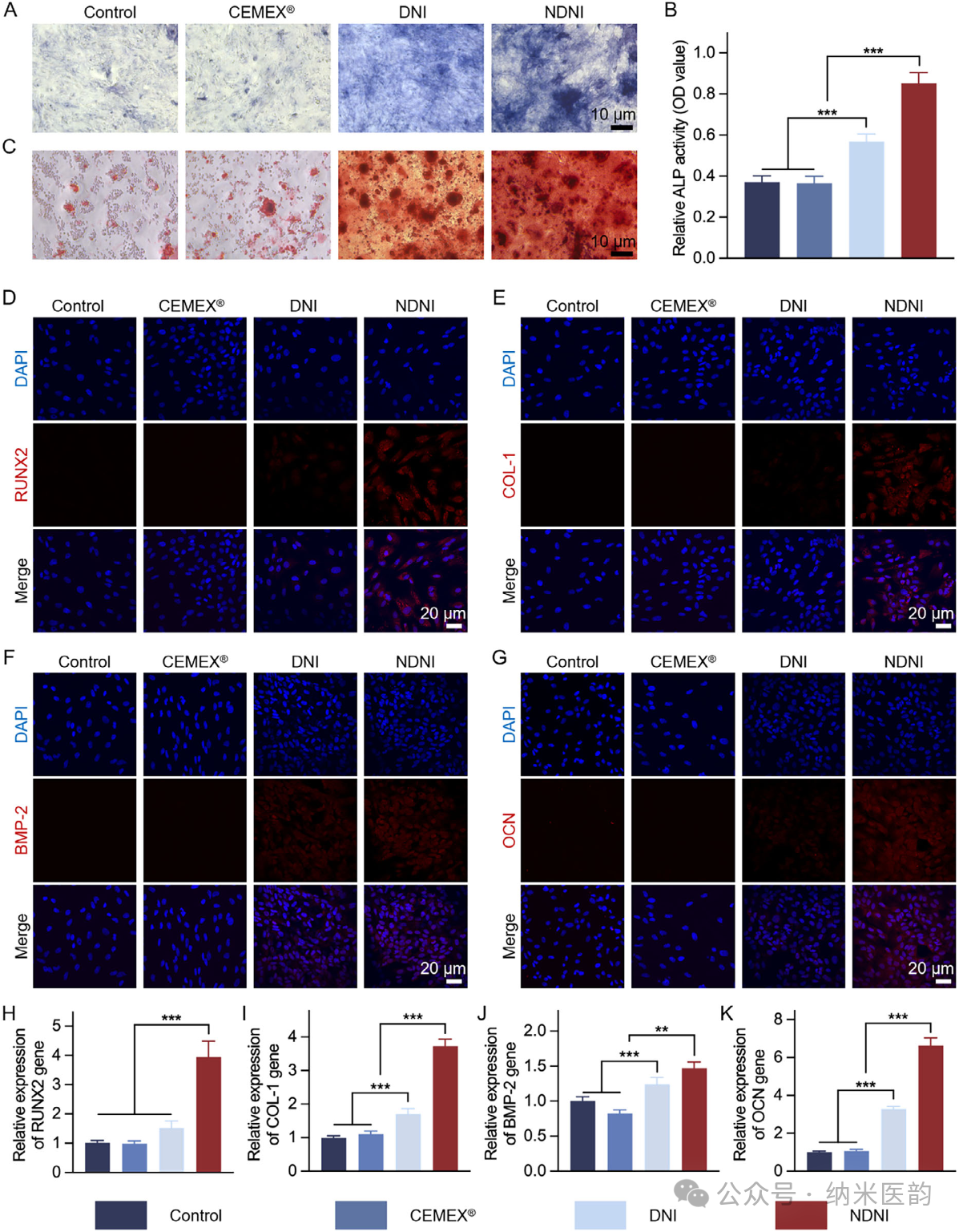
图4. NDNI对BMSCs成骨分化的体外影响。A)第7天与不同材料共培养的BMSCs的ALP染色。B)不同处理下BMSCs中ALP活性的定量分析。C)第21天与不同材料共培养的BMSCs的ARS染色。D–G)不同处理7天后BMSCs中成骨相关蛋白RUNX2(D)、COL-1(E)、BMP-2(F)和OCN(G)的免疫荧光图像(红色:成骨相关蛋白;蓝色:细胞核)。H–K)不同处理7天后细胞中RUNX2(H)、COL-1(I)、BMP-2(J)和OCN(K)mRNA表达的qRT-PCR定量分析。
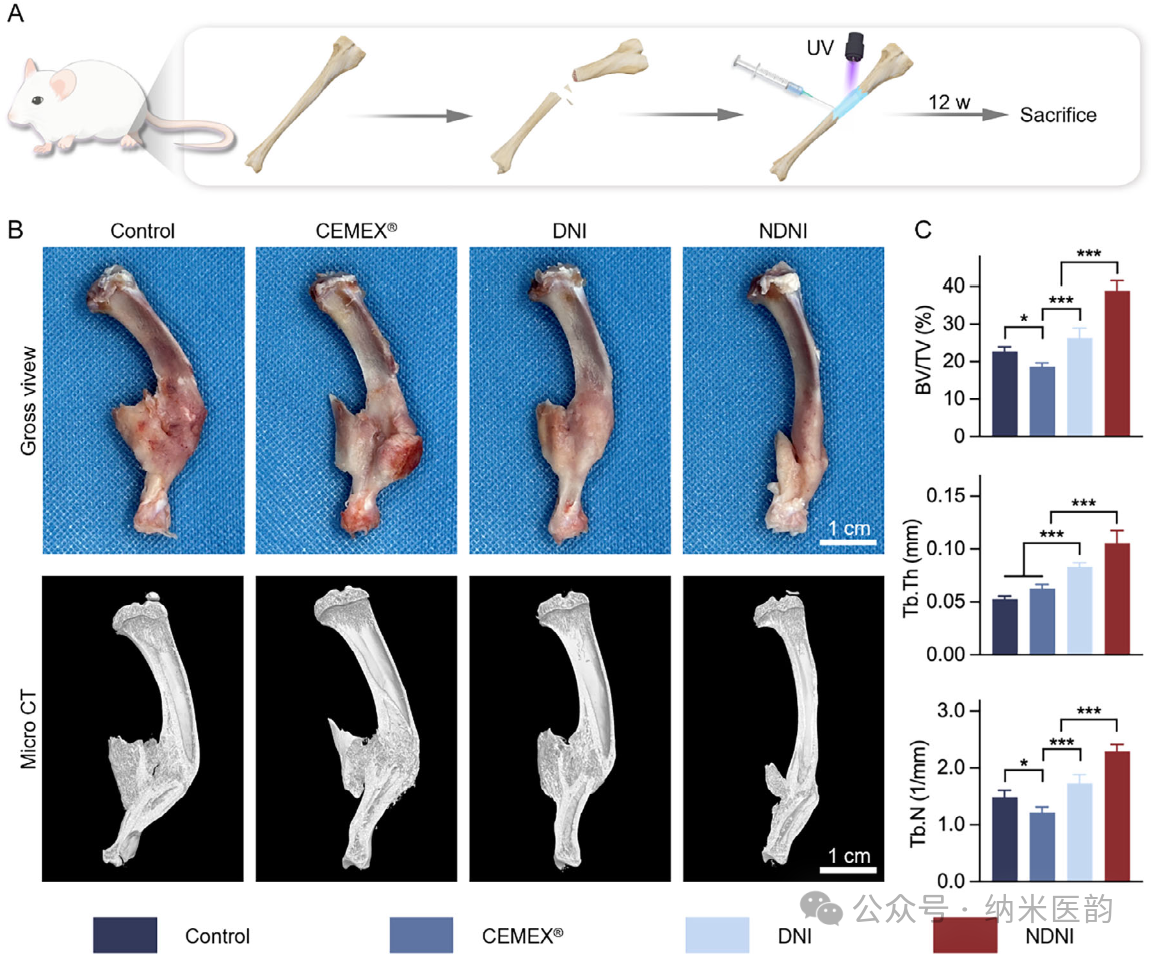
图5. NDNI在大鼠胫骨骨折模型中的体内成骨效应。A) 大鼠胫骨骨折模型及NDNI处理的示意图。B) 术后12周胫骨的照片及Micro-CT三维重建图像。C) 对骨折区域骨量的BV/TV、Tb.N和Tb.Th进行定量分析。
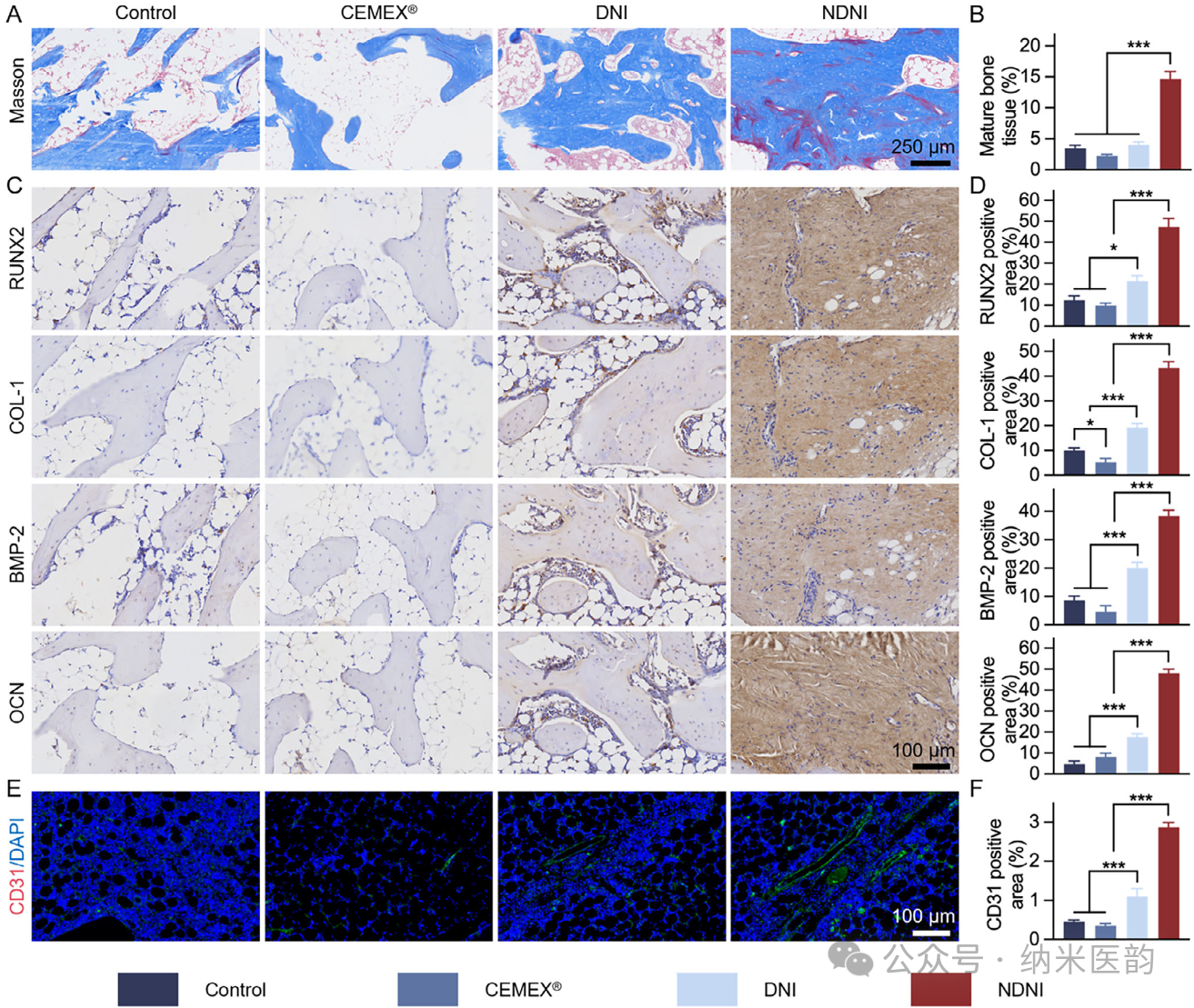
图6. NDNI 处理下胫骨再生的组织学评估。A) 术后 12 周骨组织的 MT 染色图像。B) 根据 MT 染色结果对成熟骨组织比例(红色染色)的定量分析。C) 免疫组化染色图像显示不同处理下术后骨组织中 RUNX2、COL-1、BMP-2 和 OCN 蛋白的表达。D) 根据免疫组化染色结果对 RUNX2、COL-1、BMP-2 和 OCN 表达的定量免疫组化分析。E) 不同处理下术后骨组织中 CD31 的免疫荧光染色图像(绿色:CD31;蓝色:细胞核)。F) 根据免疫荧光染色结果对 CD31 表达的定量免疫荧光分析。
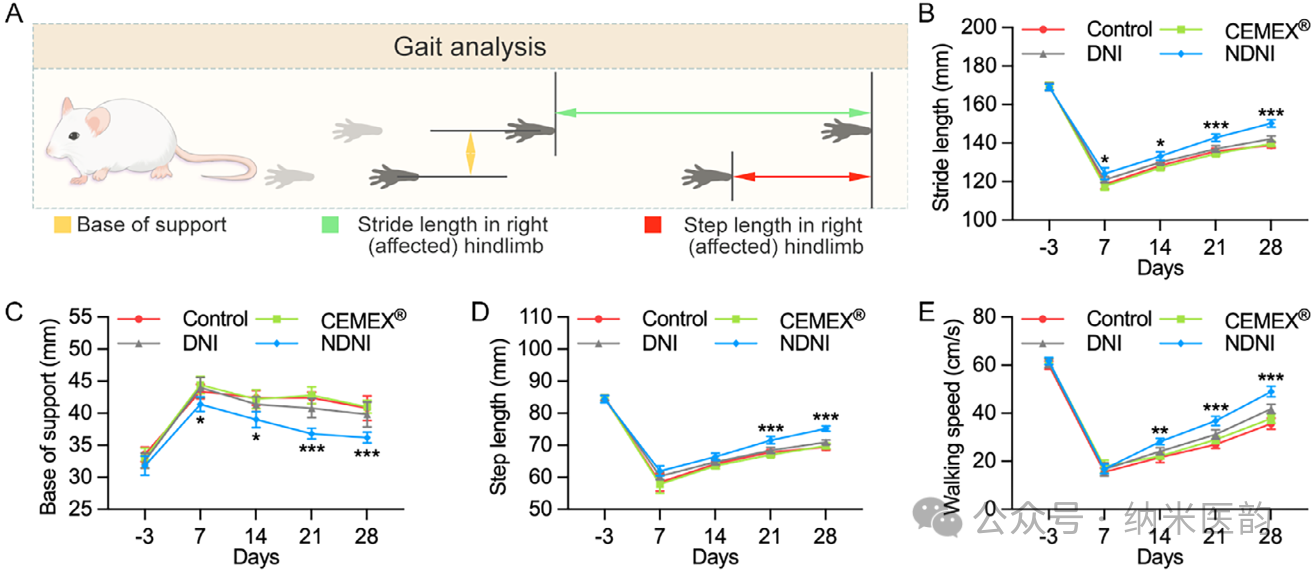
图7. NDNI 治疗胫骨再生的步态分析。A) 大鼠在跑道行走时步态特征的示意图。B–E) 不同处理随时间变化的步态参数:步幅长度 (B)、步长 (C)、支撑基底宽度 (D) 和行走速度 (E)。
总结与展望:
本研究构建了一种可注射的“双网络压电纳米陶瓷增强骨植入物”,其力学性能与天然皮质骨匹配(压缩强度≈140 MPa、弹性模量≈3.8 GPa),在体内外通过力学-生物电耦合机制同步提供结构支撑、促进血管生成、激活钙信号及成骨分化,最终实现负重骨缺损的快速、完整再生与功能恢复。
文章详情:
Dual-Network Bioactive Implant Promotes Weight-Bearing Bone Healing via Mechano-Bioelectric Coupling
Jiaming Liang, Chaonan Jin, Fangzhou Yao, Wei Sun*, Bo Li, Runzhi Xia, Jiahe Li, Yong Yu*, Ke Wang, Fan Wang, Jing Sun, Yawei Liu*, Hongjie Zhang, Kai Liu*
Cite this by DOI: 10.1002/adfm.202523587
文章链接: https://doi.org/10.1002/adfm.202523587