



摘要:受自然界启发,本研究提出了一种肽纳米框架引导的蛋白共组装策略,通过构建具有磷酸化修饰的二酪氨酸肽纳米框架,并与弹性蛋白衍生阳离子蛋白(PCP)共组装,形成具有分层结构的复合凝聚体粘附材料,实现了对材料内聚力和粘附力的精准调控,显著提升了其界面粘附强度和生物功能性。
背景介绍:
天然生物系统通过多尺度、多层次的自组装构建出具有优异性能的功能材料,尤其在粘附系统中表现出卓越的能量耗散和界面适应能力。然而,人工模拟这些复杂的分层结构仍面临巨大挑战。基于肽的超分子组装系统虽可形成多样化纳米结构,但在潮湿或生物环境中普遍存在粘附力弱、功能单一等问题,限制了其在生物医用领域的应用。
本文亮点:
1. 肽纳米框架引导的共组装策略:创新性地构建了磷酸化修饰的二酪氨酸肽(YYpS)纳米纤维框架,并与柔性阳离子蛋白(PCP)共组装,形成具有分层结构的复合凝聚体粘附剂,实现了结构可控与功能协同。
2. 超强粘附性能:该复合粘合剂在钢材界面上的搭接剪切强度高达30MPa,优于大多数已报道的超分子粘合剂,并可与化学交联型粘合剂媲美,同时具备优异的水下稳定性和可重复使用性。
3. 优异的生物相容性与生物活性:该粘附剂具备良好的细胞相容性、可降解性和低炎症反应,成功应用于大鼠和猪的多种内脏出血模型,实现快速止血(3秒内),并在皮肤创伤修复中促进组织再生和炎症抑制。
01 多肽纳米框架-PCP粘合剂的设计和表征
为实现具有超强粘附性能的肽纳米框架引导蛋白质共组装,作者设计了三种带负电荷的两亲性磷酸化肽(FFpS、FYpS和YYpS)(图1a)。这些肽均含有相同的亲水磷酸化基序,但因芳香自组装序列的差异,表现出不同的分子作用力和组装行为,从而赋予其构建适宜内聚与粘附性能的潜力。TEM结果显示,FFpS凭借极度疏水的核心形成平均长度约830 nm的长纤维,呈现典型的淀粉样纤维形态;FYpS则因酪氨酸苯酚基团造成疏水作用减弱和空间位阻,仅形成平均长度约250 nm的短纤维;而YYpS则进一步在纳米纤维间发生二级组装,形成纤维束(图1b)。这种分级结构得益于酪氨酸的引入所增强的氢键作用,尤其是二酪氨酸结构在促进纤维延伸中发挥了关键作用。由于YYpS具有两个羟基,纤维内凝聚力相对较弱,却有利于纤维间通过氢键实现分子动态交换,最终获得稳定的层次化纤维束。
另一方面,作者设计了带正电荷的柔性蛋白PCP(来源于天然弹性蛋白的重复序列(VPGXG)n,第四位氨基酸由赖氨酸或精氨酸取代)(图1c),以促进其与刚性的磷酸化肽纳米框架协同组装。该序列具有疏水骨架和高度柔性,可避免固定构象,同时丰富的正电荷有利于与肽骨架发生强烈静电相互作用。实验发现,当YYpS纤维束与PCP混合时,体系立即发生液–液相分离,形成可快速分子交换和可逆融合的球形微滴(图1e),为宏观粘合剂提供了流动性前体。进一步TEM观察发现,三种肽与PCP共组装时,唯有YYpS纤维束能保持原有形貌(图1d)。通过离心去除上清并冷冻干燥,研究者获得了高粘度的YYpS−PCPK72凝聚型胶体(图1f),表现出良好的流动性,适于进一步粘附应用。分子动力学模拟揭示,该共组装体的稳定性和超强粘附性来源于静电作用、阳离子−π作用及氢键等多重非共价相互作用(图1g)。

图1. 肽纳米框架诱导的蛋白质基粘合剂的制造和表征
02 所制粘合剂的粘附性能
随后,作者在干燥条件下,通过单轴拉伸试验评价了三种粘合剂的粘附性能(图2a)。FFpS−PCPK72、FYpS−PCPK72和YYpS−PCPK72粘合剂在钢基材上的搭接剪切强度分别约为16、19和31MPa(图2c)。值得注意的是,YYpS−PCPK72粘合剂的平均搭接剪切强度超过了大多数报道的超分子粘合剂,甚至超过了交联型化学粘合剂(图2f)。进一步实验显示,该粘合剂能将两块钢板牢固粘合到足以承受约100 kg重物,展示了YYpS−PCPK72粘合剂非凡的粘附性能(图2b)。此外,三种多肽−PCPK72粘合剂对铝材和木材基材也表现出很强的粘附性(图2d、e),显示了它们对各种粘附界面的普遍适用性。此外,我们还进一步评价了YYpS−PCPK72粘合剂的水下稳定性和可重复使用性能。YYpS−PCPK72粘合剂(粘附面积为2×1.5 cm)在水中浸泡12h后仍能承受3.5公斤的载荷(图2g),显示出其水下粘附稳定性。YYpS−PCPK72粘合剂在水中暴露1小时后,其搭接剪切强度保持在1.9 Mpa(图2h)。回收的YYpS−PCPK72粘合剂也表现出很好的粘附行为(图2i),这归因于粘合剂中动态和可逆的非共价力。
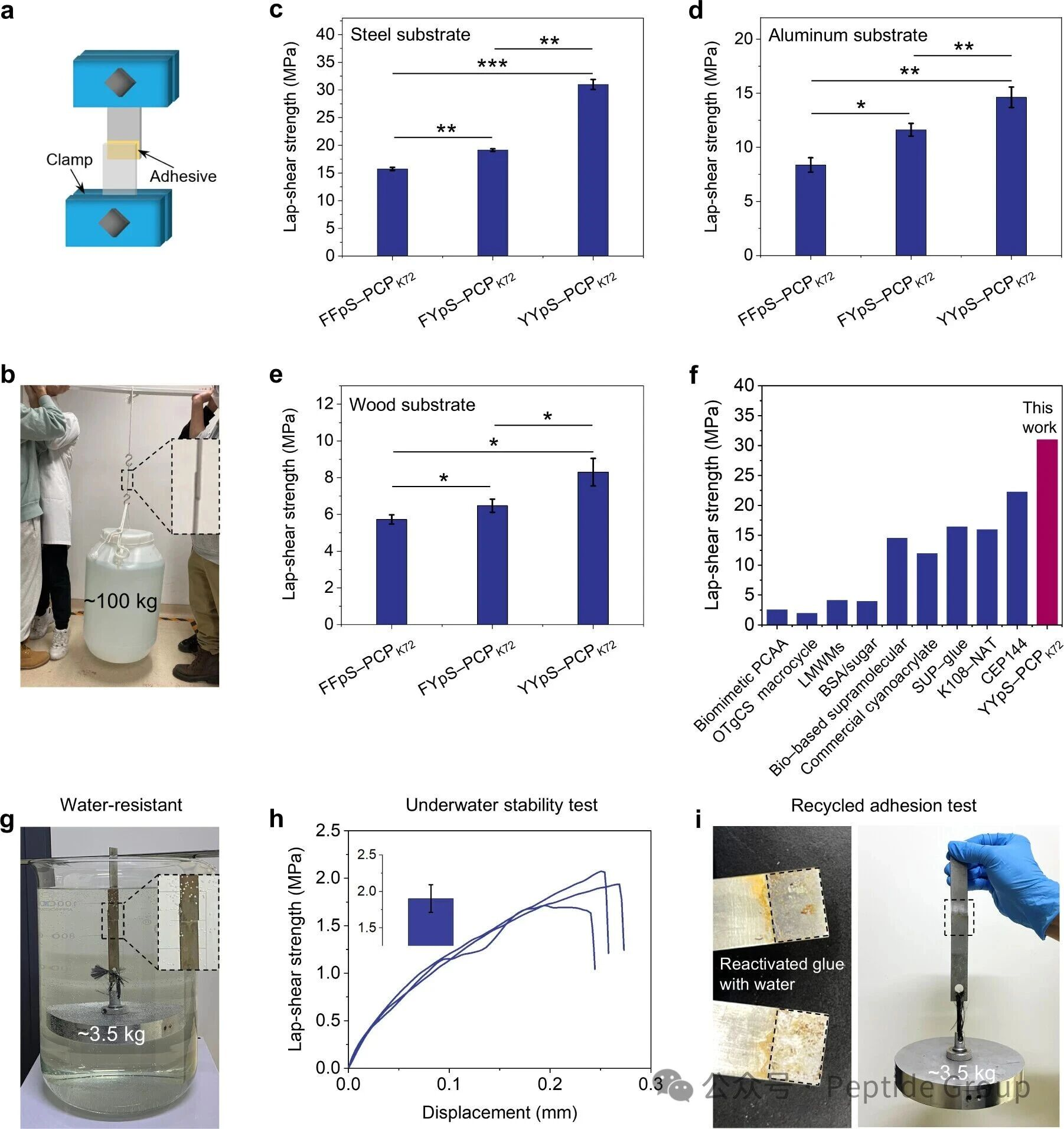
图2. 所制粘合剂的粘附性能
03 多肽纳米框架导向粘合剂的粘附机理
随后,作者通过表面力仪和分子动力学模拟研究了三种肽-蛋白复合物的分子作用机制,以揭示粘合性能的来源(图3a,b)。结果表明,YYpS肽在与PCPK72结合后由排斥力曲线转变为显著的粘附力曲线,体现了负电肽框架与正电蛋白的协同效应。分子动力学计算显示,三种肽-蛋白复合物的结合自由能存在差异,其中FFpS−PCPK72相互作用最强,但胶体内部过强的内聚削弱了界面粘合力,粘合性能最差;而YYpS−PCPK72在保持框架完整性的同时促进了蛋白伸展结合,形成致密的分级结构,从而获得最佳粘附性能(图3c–e)。为了进一步探讨氢键在组装过程中的重要性,作者基于MD模拟计算了三种多肽−蛋白复合体中的氢键数目。YYpS肽之间的氢键数量显著增加,YYpS多肽之间强大的氢键相互作用有助于纳米框架准确地诱导蛋白质共组装,并在组装过程中保持多肽框架,从而形成层次化的多肽−PCPK72框架结构。YYpS−PCPK72粘合剂的这种层次化结构不仅提高了肽/蛋白质基质的强度,而且有助于粘合剂的能量消耗,从而提高YYpS−PCPK72纳米框架粘合剂的粘附强度(图3f–h)。

图3. 多肽纳米纤维对粘附性能的调节机制
04 YYpS−PCP粘合剂的内脏止血和组织修复应用
随后,作者评估了YYpS−PCP粘合剂的生物学性能。首先,使用单轴拉伸方法定量地评估了这些粘合剂在软组织(猪皮肤)上的粘附性能(图4a)。为了进一步调节YYpS−PCP在软组织上的粘附性能,采用高分子量的精氨酸PCP制备了YYpS−PCP胶粘剂。如图4b所示,赖氨酸突变为精氨酸后,由于静电相互作用、阳离子-π相互作用和氢键的增强,YYpS−PCP胶粘剂的搭剪强度显著提高,超过了多数商业医用粘合剂(图4c)。随后采用大鼠和猪模型对YYpS−PCP粘合剂的止血性能进行了体内评价。在大鼠和猪的心脏、肝脏、肾脏、脾脏出血模型中均表现出良好的组织粘附性,并且该胶粘剂能在3秒内实现止血封堵,展现了快速有效的止血性能(图4d–m)。

图4. 湿性组织粘连及创面止血凝胶剂的定量及应用

图5. YYpS−PCP粘合剂的组织修复应用
总结与展望:
综上所述,本文提出了一种肽纳米框架引导的蛋白共组装策略,成功构建出具有分级结构的高性能粘合剂。研究表明,磷酸化YYpS肽与PCP蛋白形成的共组装体系在钢材上的搭接剪切强度高达31 MPa,性能超过大多数超分子胶甚至化学交联型粘合剂,并且在多种基底、水下环境及循环使用条件下均表现出优异的粘合性能。机制研究揭示了氢键、电荷作用和π−π相互作用协同作用下的结构稳定性和平衡的内聚–粘附特性。进一步的动物实验验证了该粘合剂良好的生物相容性、可降解性及其快速止血和促进组织修复的能力。整体而言,该工作为开发高强度、可生物降解且具备临床应用潜力的新型功能性粘合剂提供了新思路。
文章详情:
Dynamic Peptide Nanoframework-Guided Protein Coassembly: Advancing Adhesion Performance with Hierarchical Structures
Yusai Zhou, Rong Chang, Zhenyue Yang, Qi Guo, Mengyao Wang, Bo Jia, Bo Li, Bodan Deng, Yubin Ren, Huaxia Zhu, Xinyan Wang, Qinrui Wang, Han Wen, Hongjie Zhang, Jing Yu*, Yong-Xiang Chen*, Kai Liu*
Cite this by DOI: 10.1021/jacs.4c10882
文章链接: https://pubs.acs.org/doi/10.1021/jacs.4c10882