



摘要:中国科学院长春应用化学研究所张洪杰、冯婧团队设计并制备了两种镧系纳米颗粒(Ln-DSPE和Ln-DBCO),通过调节中间层比例,实现了1064 nm和1525 nm的NIR-II发射。1064 nm发射适用于深部组织成像,而1525 nm发射则适用于高分辨率血管成像。研究通过体外和体内实验验证了这些纳米颗粒在生物正交成像中的应用潜力,包括原位肝肿瘤成像和全身血管成像。
背景介绍:
荧光成像技术因其高灵敏度、高时空分辨率和多通道成像能力而备受关注。第二近红外窗口(NIR-II,1000-1700 nm)由于其较低的组织吸收和散射,相比可见光和第一近红外窗口(NIR-I,700-900 nm)具有更高的成像深度和分辨率。然而,NIR-II区域内的不同波长在体内成像中的表现尚未被充分研究。
本文亮点:
波长可切换的NIR-II发射:通过调节镧系纳米颗粒的中间层比例,实现了1064 nm和1525 nm的NIR-II发射,分别适用于深部组织成像和高分辨率血管成像。
生物正交成像:通过铜催化的点击化学反应,实现了原位肝肿瘤的特异性成像。
高分辨率血管成像:1525 nm发射的纳米颗粒在NIR-IIb区域表现出极低的背景干扰和高分辨率,能够清晰区分小血管。
良好的生物相容性:实验表明,这些纳米颗粒具有良好的生物相容性和低毒性,适合用于体内成像。
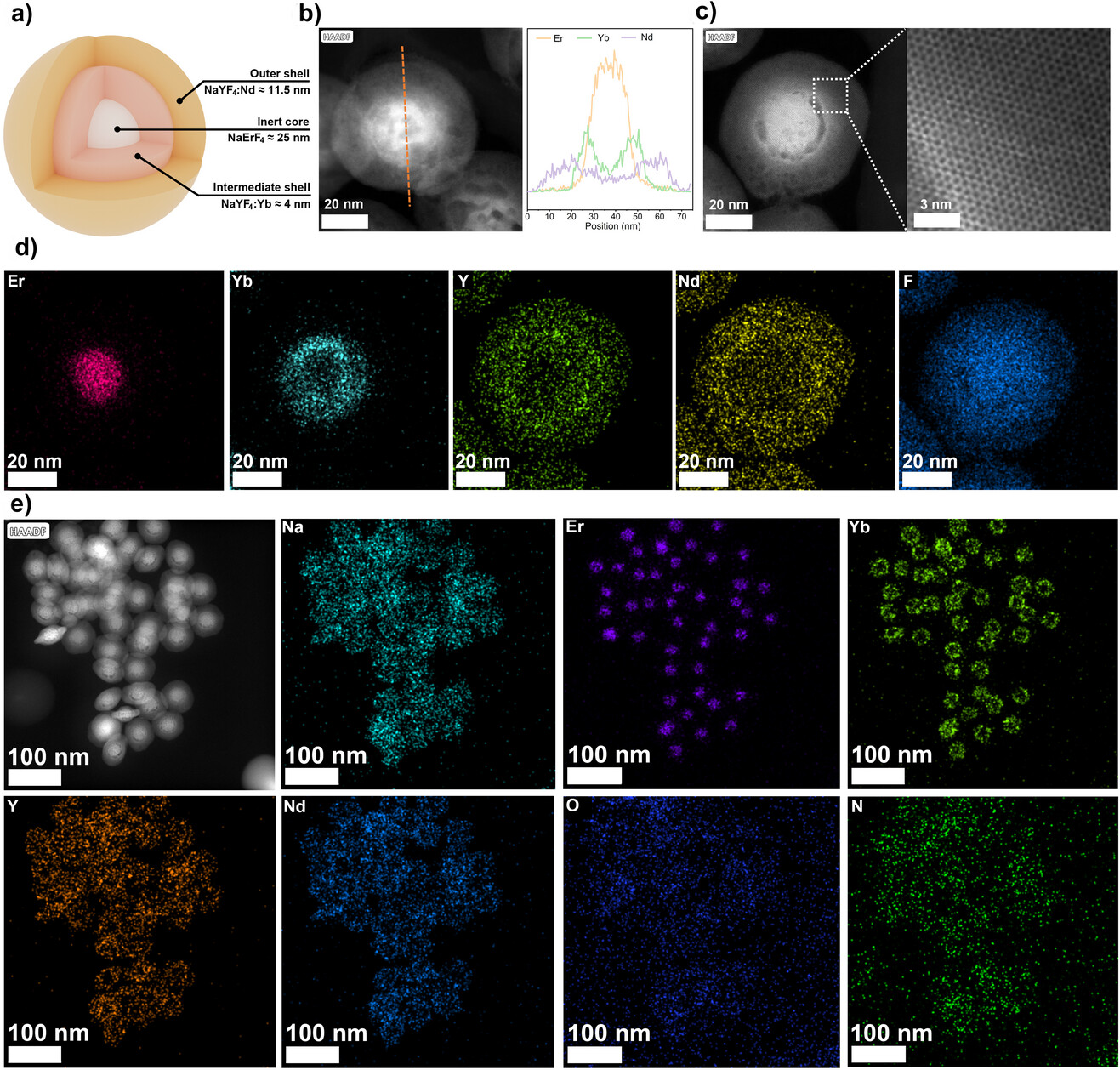
图1. 镧系纳米颗粒的透射电子显微镜(TEM)表征,包括其核心、中间层和外壳的结构。通过能量色散光谱(EDS)元素分布图,确认了各元素在各自层中的均匀分布。
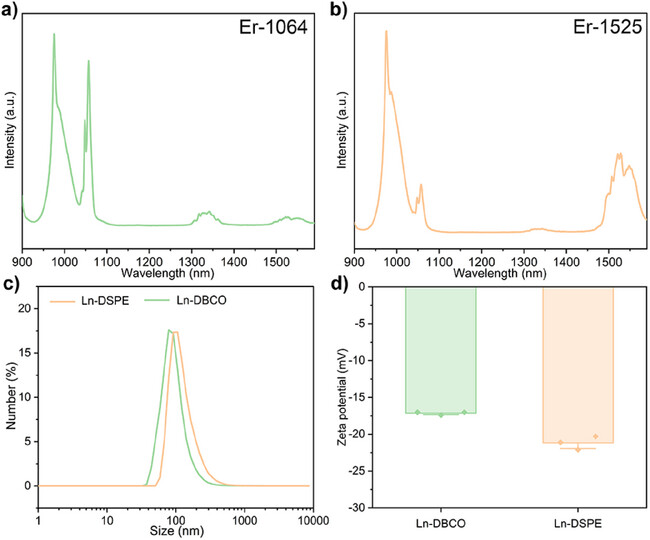
图2. Er-1064和Er-1525的NIR-II发光光谱,以及表面修饰后的纳米颗粒的粒径和zeta电位分析,表明其适合用于生物体内实验
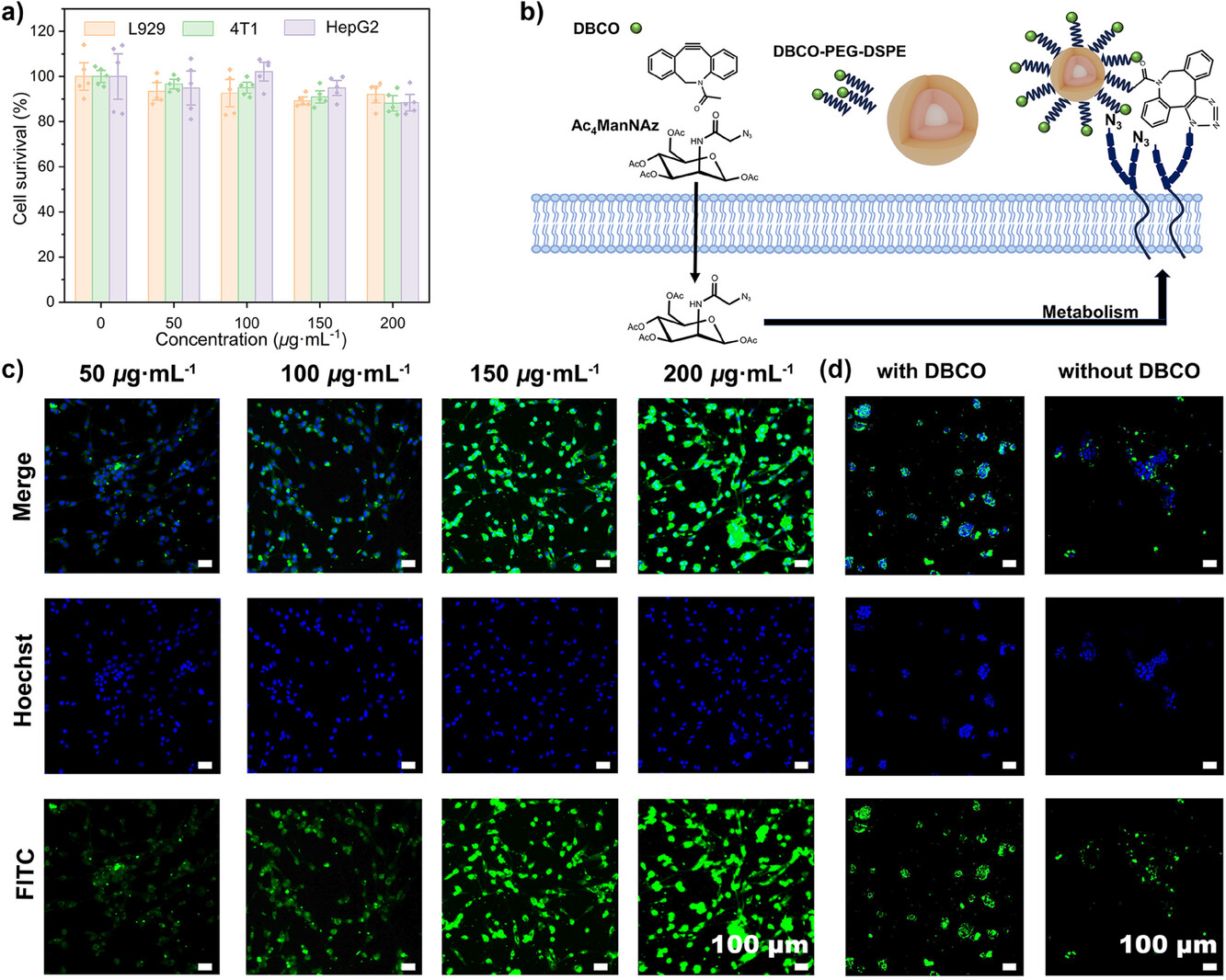
图2.通过细胞实验验证了Ln-DBCO的生物相容性和细胞摄取能力。结果表明,Ln-DBCO具有良好的细胞摄取性能,且在高浓度下仍保持较高的细胞活性。
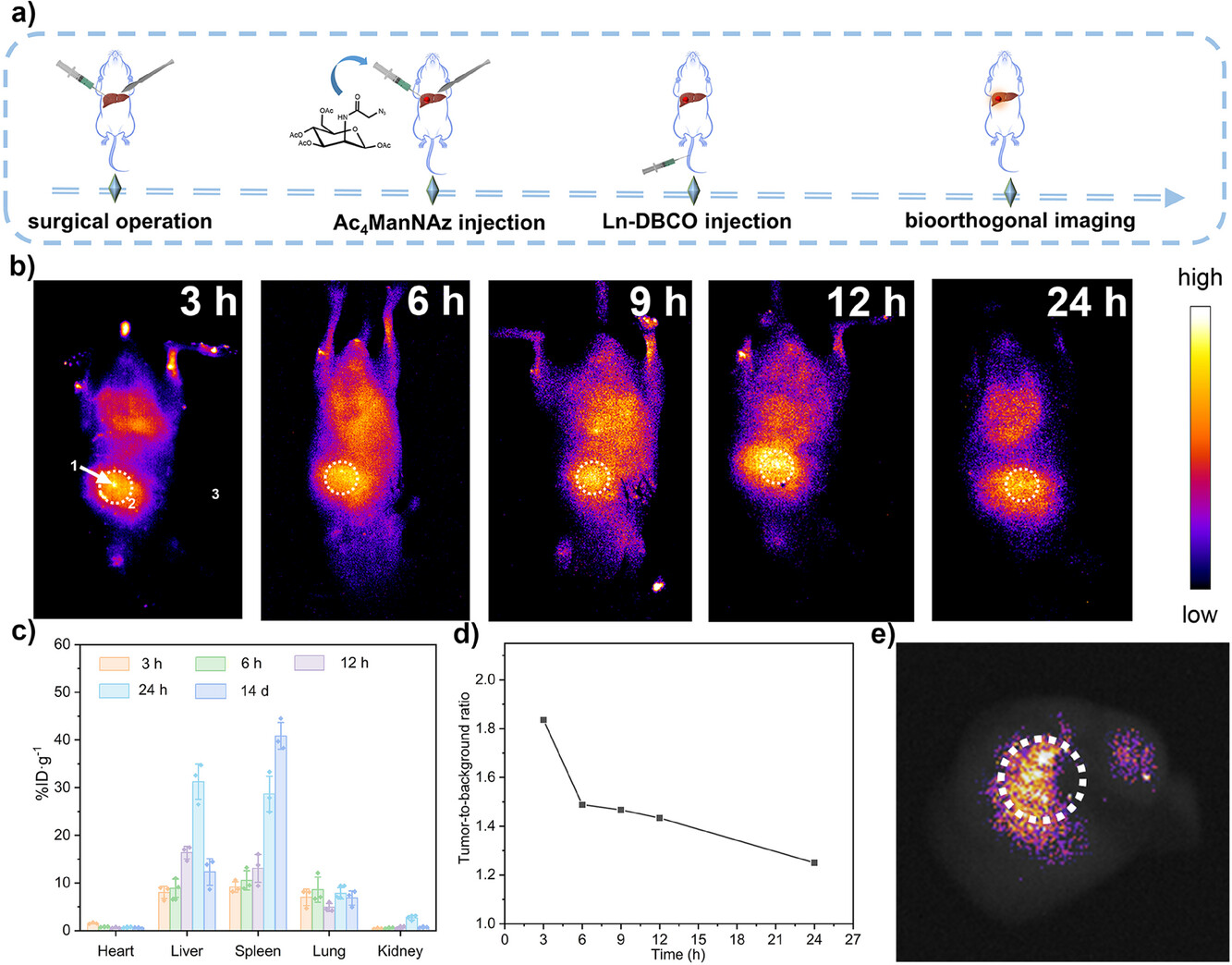
图4. 原位肝肿瘤模型的体内生物分布和NIR-II荧光成像结果。通过尾静脉注射Ln-DBCO,实现了对肿瘤部位的快速积累和清晰成像。
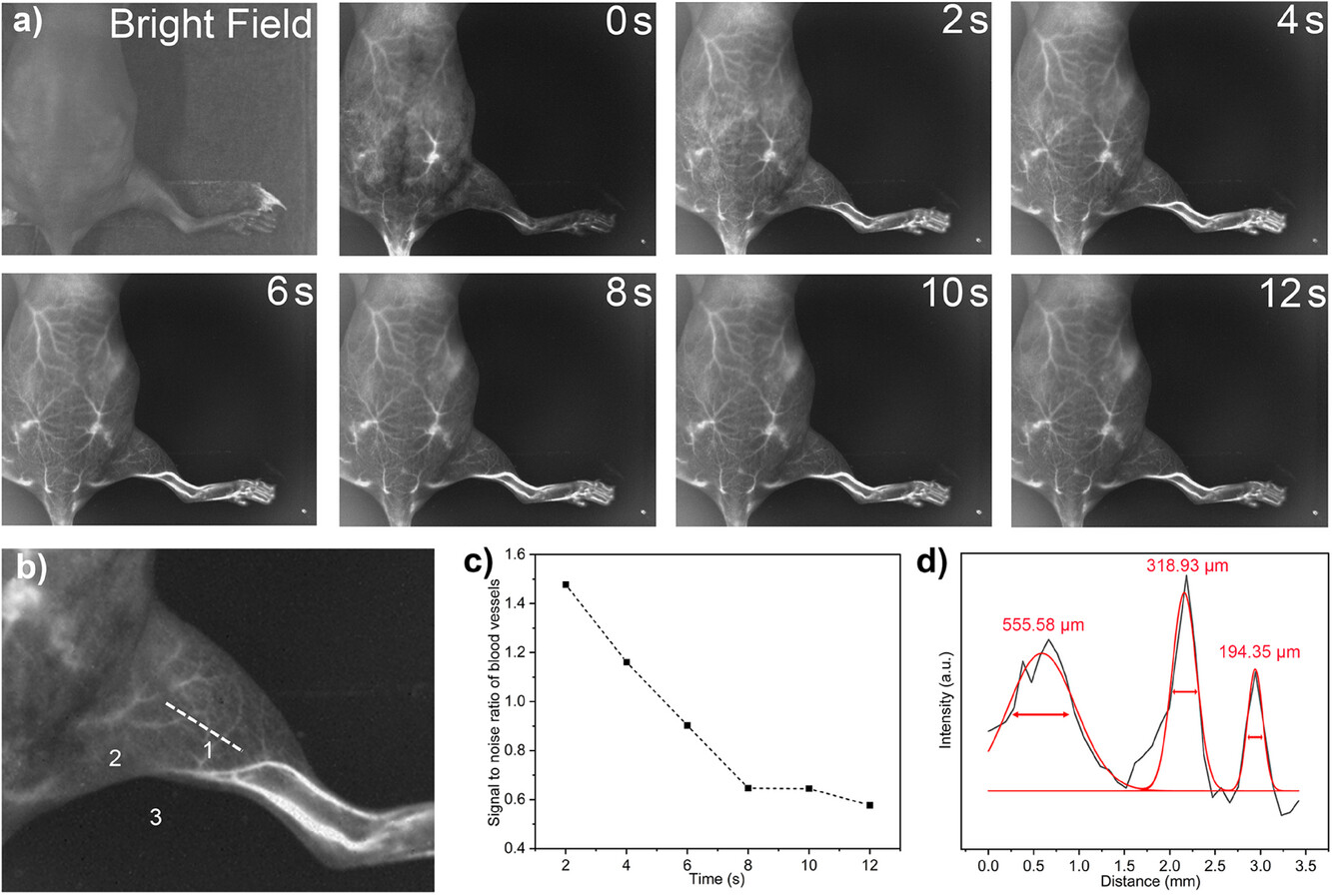
图5. 全身血管成像的结果,证明了Ln-DSPE在1525 nm发射下能够实现高分辨率的血管成像,能够清晰区分小血管,并具有良好的时空分辨率。
总结与展望:
作者通过调节镧系纳米颗粒的中间层比例,成功实现了1064 nm和1525 nm的NIR-II发射,并分别应用于深部肝肿瘤成像和高分辨率血管成像。研究结果表明,1064 nm发射适用于深部组织成像,而1525 nm发射则在高分辨率血管成像中表现出色。通过生物正交化学反应,实现了原位肝肿瘤的特异性成像,为肿瘤的早期诊断和治疗提供了新的工具。此外,这些纳米颗粒在体内表现出良好的生物相容性和低毒性,适合用于临床前和临床应用。展望未来,这种基于镧系纳米颗粒的成像技术有望在更多疾病模型中实现应用,例如在神经退行性疾病或心血管疾病的诊断中。通过进一步优化纳米颗粒的结构和功能,可以开发出更多高性能的成像探针,以满足不同的临床需求。此外,该研究中采用的中间层调节策略为设计新一代NIR-II成像剂提供了重要的参考,有望推动荧光成像技术在生物医学领域的进一步发展。随着技术的不断进步,镧系纳米颗粒有望在精准医疗和个性化诊断中发挥更大的作用,为疾病的早期诊断和治疗提供有力支持。
文章详情:
Intermediate Layer-Engineered Lanthanide Nanoparticles Enable Deep Bioorthogonal Liver Tumor and Vascular Imaging via Switchable NIR-II Emissions
Kehong Lv, Hongxia Yue, Chunyan Li, Shengzhe Chen, Hongli Wang, Ruohao Zhang, Jing Feng*, Hongjie Zhang*
Cite this by DOI: 10.1002/anie.202507787
文章链接: https://doi.org/10.1002/anie.202507787