



前 言
本技术规范按照GB/T 1.1-2009给出的规则起草。
为积极响应国务院《深化标准化工作改革方案》中大力培育发展团体标准、扩大标准有效供给的号召,同时也为了尽快将科技成果向标准转化、推动技术进步,为建设新型标准体系贡献力量,特制定本技术规范,以更好发挥标准化在服务支撑经济社会发展中的基础性、战略性作用。现广泛征求相关单位和个人宝贵意见。
本技术规范由中国科学院提出,由国家纳米科学中心起草,旨在为聚合物载药纳米胶束体外释放度测试方法提供技术指导。
本技术规范主要起草人:梁兴杰、吴雁、葛广路、张东慧、李宪磊
聚合物载药纳米胶束体外释放度测试方法
——透析法/离心法检测聚合物载药胶束体外释放
Method of drug release in vitro for drug-loaded polymer micelle
——Dialysis/Centrifugation for Drug Release measurement of Polymer Micelles in vitro
1 范围
本标准规定了采用透析法和离心法测定高分子纳米胶束体外释放度的相关术语和定义、原理、仪器和试剂、方法及步骤、结果表示以及检测报告。
本标准适用于应用透析法或离心法对聚合物载药纳米胶束中药物的体外释放度进行测试和分析。
2 规范性引用文件
下列文件为本文件所引用,对本文件的应用必不可缺。凡是注明日期的引用文件,则仅注明日期的版本适用于本文件。凡不注明日期的引用文件,其最新版本(包括最新的修改单)适用于本文件。
《中华人民共和国药典》2015版
GBT 50902-2013医药工程基本术语标准
3 术语和定义
《中华人民共和国药典》2015版 、GBT 50902-2013中界定的以及下列术语和定义适用于本文件。
3.1 释放度 drug release
释放度指药物从缓释制剂、控释制剂、肠溶制剂及透皮贴剂等在规定条件下释放的速率和程度[1]。
3.2 体外药物释放度试验 experiment of drug release in vitro
体外药物释放度试验是在模拟体内消化道和血液等条件下(如温度、介质的pH值、搅拌速率等),对制剂进行药物释放速率试验,最后制订出合理的体外药物释放度,以监测产品的生产过程与对产品进行质量控制[1]。
3.3 透析法 dialysis method
透析法是利用小分子药物在溶液中可通过半透膜,而大分子的聚合物载药纳米胶束不能通过半透膜的性质,达到分离的方法。
3.4 离心法 centrifugation method
利用物质的密度等方面的差异和旋转所产生的离心力使颗粒或者溶质沉淀发生沉降而将其分离、浓缩、提纯和鉴定的一种方法[2]。
3.5 蛋白质类药物 protein drug
蛋白质类药物是指来源于动、植物和生物应用技术研究开发的具有一定生物活性,用于防治和诊断人类、动物和植物疾病的蛋白质产品。
4 释放度测试方法—透析法
4.1 适用范围
负载常规亲水或疏水药物(如阿霉素、紫杉醇等非蛋白质类药物)聚合物载药纳米胶束的体外释放度测试一般采用透析法。
4.2 基本原理
透析法是目前进行聚合物载药纳米胶束体外释放度测定的常用方法。通常聚合物载药纳米胶束溶液装在透析膜中,具有较高的药物浓度或者渗透压,透析膜外的释放介质具有较低的药物浓度或者渗透压,透析膜的两侧存在渗透压差,小分子药物在膜两侧渗透压差的驱动下,通过透析膜的孔径进入到释放介质中,从而使两侧的渗透压差减小。从化学动力学的角度分析,该过程是一个自动且不可逆的过程。虽然大分子的聚合物纳米胶束在膜两侧的渗透压也存在差异,但是透析膜的孔径(或是截留分子量)不允许纳米胶束透过,因此只有从聚合物载药纳米胶束中释放出来的小分子药物才能通过透析膜进入到释放介质中。
4.3 仪器及试剂
4.3.1.恒温振荡培养箱
包含有箱体、振荡系统、加热系统、控制系统(转速和温度)、照明系统、计时系统。
4.3.2 透析膜
透析膜不能对药物及纳米胶束有吸附,同时不能影响药物及纳米胶束的活性[1]。产生透析膜截留分子量应大于释放药物的分子量而小于纳米胶束的分子量。
4.3.3 高效液相色谱仪(HPLC)
高效液相色谱仪一般用于检测有紫外吸收的物质。系统由储液器、泵、进样器、色谱柱、检测器、记录仪等组成。可自动将待测物质与溶剂及其它杂质分离开来并进行药物浓度的测定。
4.3.4 荧光光谱仪
用于测定有荧光药物的浓度,如阿霉素。
4.3.5 电感耦合等离子体质谱(ICP-MS)
用于金属元素顺铂等药物浓度的测定。
4.3.6 磷酸盐缓冲液
在实验中起到释放介质的作用,用脱气的新鲜纯化水进行配置,为避免保存时产生污染,最好现用现配。
4.3.7 表面活性剂
提高疏水药物在缓冲介质中的溶解性和稳定性,保证释放出的药物能够顺利
通过透析膜进入缓冲介质中。
注:常用的表面活性剂有吐温80、吐温20、叠氮化钠、十二烷基硫酸钠、聚氧乙烯蓖麻油等。
4.4 实验条件
释放温度:根据模拟环境和用药方式而定。缓释、控释、迟释制剂模拟胃部和血液等体液环境,温度应控制在37℃±0.5℃。但贴剂应在32℃±0.5℃模拟表皮温度[1]。
释放介质pH:根据模拟环境而定,模拟胃液环境pH建议设置为1.2~7.6。模拟血液等正常体液环境pH建议设置为7.4,模拟肿瘤细胞外微环境pH设置范围为6.5~7.2,模拟肿瘤细胞内环境pH设置范围为4~6,其中内涵体pH值为5~6,溶酶体的pH值为4~5[3]。
释放介质体积:释放介质的体积应符合漏槽条件[3]。漏槽状态即药物所处释放介质的浓度远小于其饱和浓度。
释放转速:70rpm~180rpm
亮度:对于光敏感药物需要避光测定。
取样时间:原则上至少取三个时间点,第一个点为开始0.5~2h的取样时间点,用于考察药物是否有突释现象,中间取样点为了确定载药系统的释药特性,最后一个时间点考察药物释放是否完全。且释放度全过程不低于给药时间且释放药物要达到药物总量的90%以上[1]。在实际操作中,建议根据药物的释药特性进行多个时间点的选择。所选时间点必须能够反映药物的突释、缓释以及完全释放的程度。取样时间点越密集,越能反映释药过程。
4.5 实验方法和步骤
4.5.1 配制释放介质
磷酸盐缓冲液通常用作释放介质。一般用购买的标准液加脱气的新鲜去离子水稀释配制,为防止保存过程中产生污染,最好现用现配。
4.5.2 安装透析装置
将适量的药物完全溶解在2mL~5mL去离子水中,制备成载药纳米粒子水分散体系。将载药纳米粒子水分散体系置于透析管或封端的透析膜内,透析管或封端的透析膜浸于装有30mL~40mL的释放介质的50mL离心管中。对于疏水药物需要在释放介质中加入0.02%~4%(w/v)的表面活性剂,如吐温20,吐温80,叠氮化钠(NaN3),十二烷基硫酸钠、聚氧乙烯蓖麻油。
4.5.3 药物释放
将透析装置垂直置于恒温振荡培养箱内。培养箱参数(温度、转速及亮度)根据模拟环境要求进行相应的设置。在指定时间取0.5mL~3mL释放介质进行浓度的测定,并补充相同体积、温度和pH的释放介质,以保证释放介质的总体积保持不变。
4.5.4 药物浓度测定
根据药物性质,采用相应检测仪器对释放药物进行浓度检测,释放出的药物浓度应位于检测仪器的检测限之内。
对于有紫外吸收的药物可采用紫外光谱仪或高效液相色谱仪(HPLC)进行浓度的检测。为提高实验精度,建议采用高效液相色谱仪(HPLC)进行药物浓度的测定。
对于有荧光的药物可用荧光光谱仪进行药物的定量测定。
金属元素顺铂等药物浓度的测定一般采用电感耦合等离子体质谱即ICP-MS进行测定 。
4.5.5 计算药物累积释放率
药物累积释放量计算公式如下
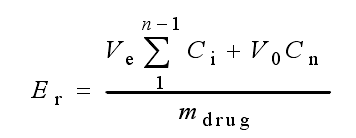
Er:药物累计释放量; Ve:PBS的置换体积; V0:释放介质总体积; Ci:第i次置换取样时释放液的浓度; mdrug:纳米粒子所载药物总质量; n:置换PBS的次数。
重复实验三次,测量结果取平均值,且要求相关性P<0.05。根据以上公式计算出每个取样点的累积释放药物量。
4.5.6 绘制释放曲线
采用绘图软件绘制释放曲线,纵坐标为药物累积释放百分率,横坐标为取样时间。
5 释放度测试方法——离心法
5.1 适用范围
负载常规亲疏水药物和蛋白质类药物聚合物载药纳米胶束的体外释放度测试一般采用离心法。
5.2 基本原理
离心法是利用不同物质间的密度、质量等的差异,用旋转所产生的离心力使颗粒或者溶质沉淀发生沉降而将其分离、浓缩、提纯和鉴定的一种方法。
负载蛋白质类药物聚合物纳米胶束在释放介质中将药物释放到溶液中,聚合物纳米胶束质量较大,而蛋白质类药物质量较小,在旋转所产生的离心力的作用下,质量较大的聚合物纳米胶束沉降到溶液的底部,而相对质量较低的蛋白质类药物以悬浮液的形式存在于溶液中,通过测量悬浮液中药物的浓度和体积,便能得到药物在此时间点的释放情况。
5.3 仪器及试剂
5.3.1 恒温振荡培养箱
包含有箱体、振荡系统、加热系统、控制系统(转速和温度)、照明系统、计时系统。
5.3.2 离心机
包含离心系统和温控系统。
5.3.3 高效液相色谱仪(HPLC)
高效液相色谱仪一般用于检测有紫外吸收的物质。系统由储液器、泵、进样器、色谱柱、检测器、记录仪等组成。可自动将待测物质与溶剂及其它杂质分离开来并进行药物浓度的测定。
5.3.4 荧光光谱仪
用于测定有荧光药物的浓度,如阿霉素。
5.3.5 BCA蛋白浓度测定试剂盒
用于蛋白质类药物浓度的测定。
5.3.6 磷酸盐缓冲液
在实验中起到释放介质的作用,用脱气的新鲜纯化水进行配置,为避免保存时产生污染,最好现用现配。
5.3.7 表面活性剂
提高疏水药物在缓冲介质中的溶解性和稳定性,保证释放出的药物能够顺利
通过透析膜进入缓冲介质中。
注:常用的表面活性剂有吐温80、吐温20、叠氮化钠、十二烷基硫酸钠、聚氧乙烯蓖麻油等。
5.4 实验条件
释放温度:根据模拟环境和用药方式而定。缓释、控释、迟释制剂模拟胃部和血液等体液环境,温度应控制在37℃±0.5℃。但贴剂应在32℃±0.5℃模拟表皮温度[1]。
释放介质pH:根据模拟环境而定,模拟胃液环境pH建议设置为1.2~7.6。模拟血液等正常体液环境pH建议设置为7.4,模拟肿瘤细胞外微环境pH设置范围为6.5~7.2,模拟肿瘤细胞内环境pH设置范围为4~6,其中内涵体pH值为5~6,溶酶体的pH值为4~5[3]。
释放介质体积:释放介质的体积应符合漏槽条件[3]。漏槽状态即药物所处释放介质的浓度远小于其饱和浓度。
释放转速:70rpm~180rpm
离心转速:8000rpm~14000rpm
离心时间:5min~30min
离心温度:4℃或25℃
亮度:对于光敏感药物需要避光测定。
取样时间:原则上至少取三个时间点,第一个点为开始0.5~2h的取样时间点,用于考察药物是否有突释现象,中间取样点为了确定载药系统的释药特性,最后一个时间点考察药物释放是否完全。且释放度全过程不低于给药时间且释放药物要达到药物总量的90%以上[1]。在实际操作中,建议根据药物的释药特性进行多个时间点的选择。所选时间点必须能够反映药物的突释、缓释以及完全释放的程度。取样时间点越密集,越能反映释药过程。
5.5 实验方法和步骤
5.5.1 配制释放介质-磷酸盐缓冲液
磷酸盐缓冲液通常用作释放介质。一般用购买的标准液加脱气的新鲜去离子水稀释配制,为防止保存过程中产生污染,最好现用现配。
5.5.2 药物释放
将适量的聚合物载药纳米胶束溶于5mL~30mL的释放介质中。对于疏水药物需要在释放介质中加入0.02%~4%(w/v)的表面活性剂,如吐温20,吐温80,叠氮化钠NaN3,十二烷基硫酸钠、聚氧乙烯蓖麻油。置于恒温振荡培养箱中进行药物释放。培养箱参数(温度、转速及亮度)根据模拟环境要求进行相应的设置。在特定时间点取0.5mL~3mL样品于离心管中,并补加相同体积、温度和pH值的释放介质,保证释放介质的条件保持不变。
5.5.3 离心
将离心管置于离心机上,离心机转速设置为8000rpm~14000rpm,离心机时间设置为5min~30min,离心机温度设置为4℃或25℃。离心得到的上清液用于下一步的浓度检测。
5.5.4 药物浓度测定
根据药物性质,采用相应检测仪器对释放药物进行浓度检测,释放出的药物浓度应位于检测仪器的检测限之内。
对于有紫外吸收的药物可采用紫外光谱仪或高效液相色谱仪(HPLC)进行浓度的检测。为提高实验精度,建议采用高效液相色谱仪(HPLC)进行药物浓度的测定。
对于有荧光的药物可用荧光光谱仪进行药物的定量测定。
金属元素顺铂等药物浓度的测定一般采用电感耦合等离子体质谱即ICP-MS进行测定。
对于没有紫外吸收和荧光的蛋白质类药物建议利用BCA蛋白浓度测定试剂盒测定。
5.5.5 计算药物累积释放率
药物累积释放量计算公式如下
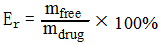
Er:药物累计释放量;mfree:纳米粒子释放出的药物质量;mdrug:纳米粒子所载药物总质量。重复实验三次,测量结果取平均值,且要求相关性P<0.05。根据以上公式计算出每个取样点的累积释放药物量。
5.5.6 绘制释放曲线
采用绘图软件绘制释放曲线,纵坐标为药物累积释放百分率,横坐标为取样时间。
6 结果表示
采取释放曲线和语言描述相结合的方式。
7 检测结果报告
检测报告应包括以下信息:
a) 检测报告编号;
b) 送检样品名称、送检日期和送检目的;
c) 送样人姓名,单位,地址,及联系方式;
d) 仪器型号、测试方法及条件(转速、温度、pH);
e) 检测结果和必要的说明(附原始数据和释放曲线);
f) 测试过程中出现的异常现象;
g) 本标准中未明确的操作步骤和注意事项,可能对测试结果产生的影响;
h) 检测报告负责人签名;
i) 检测报告的日期;
j) 实验室名称及地址。
8 备注
透析法和离心法测定聚合物载药胶束释放度实验模拟的是体内肠道或者血液的环境,其温度、pH以及搅拌速度都接近于体内肠道或者血液的环境,从而使体外释放试验的结果更接近于体内释放的结果。但是由于体内环境和成分的复杂性,目前常用的释放模型不能对体内环境和成分进行百分之百的模拟,因此不能机械地将体外释放试验的结果和药物在体内的缓控释情况等同看待。
附录A
(资料性附录)
A.1 透析法测定载紫杉醇(疏水药物)聚合物纳米胶束释放度[4]
实验条件:
释放温度:37℃ 释放转速:100rpm 亮度:无需避光
释放介质pH:7.4(模拟体液pH)、5.0(模拟肿瘤细胞内pH)
实验过程:
配置pH值5.0和7.4的磷酸盐缓冲液各40mL置于50m离心管中,向离心管中加入0.1% (w/v)的吐温80。将上述离心管置于37℃、100rpm的恒温振荡培养箱中。待缓冲液温度稳定之后,将装有2.0mL、1.0mg/mL聚合物载药纳米胶束的透析管(截留分子量3500Da)放入50mL离心管中。在设定时间点分别取3.0mL离心管中的释放介质,同时补加相同体积、温度和pH的缓冲液。每个试样重复三次。待取样完成后利用高效液相色谱仪(HPLC)进行浓度的测定。然后根据释放度公式计算各个时间点的释放度,且要求相关性P<0.05。最后用绘图软件绘制累积释放曲线图。

Fig.1. pHdependent PTX release from the PPBV micelles at different pH values in PBS Buffer
A.2 离心法测定载牛血清白蛋白(BSA)聚合物纳米胶束释放度[5]
实验条件:
释放温度:37℃ 离心温度:25℃ 亮度:无需避光
释放转速:120rpm 离心转速:13000rpm 离心时间:10min
释放介质pH:7.4(模拟体液pH)
实验过程:
将一定量的负载牛血清白蛋白(BSA)的聚合物载药纳米胶束加入到装有8mL、pH=7.4磷酸盐缓冲液的离心管中。然后将该离心管置于120rpm、37℃恒温振荡培养箱中进行药物的释放。在特定时间点取出1mL样品,同时补加1mL相同温度和pH值的磷酸盐缓冲液。将取出的样品进行离心,离心机参数设置为25℃13000rpm、10min,离心完成后取上清液进行浓度测定。每个试样重复三次。待取样完成后,利用BCA蛋白浓度测定试剂盒测定上清液的浓度,从而计算出该时间点的药物累积释放度,且要求相关性P<0.05。最后用绘图软件绘制累积释放曲线图。
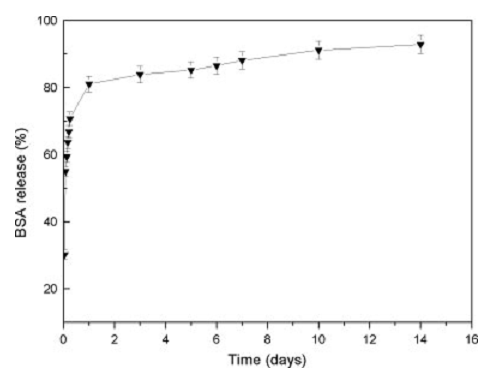
Fig.2.In vitro release profile of BSA from HPAE-co-PLA micelles
参考文献
[1]《中华人民共和国药典》2015年版 二部,北京,中国医药科技出版社
[2] GBT 50902-2013 医药工程基本术语标准
[3] Simona Mura, Julien Nicolas and Patrick Couvreur*. Stimuli-responsive nanocarriers for drug delivery. Nature Materials ,2013,12,991-1003
[4] Xiangang Huang , Xulin Jiang *, Qizhi Yang , Yanfeng Chu , Guangyan Zhang , Bin Yang and Renxi Zhuo. Triplestimuli (pH/thermo/reduction) sensitive copolymers for intracellular drug delivery. J. Mater. Chem. B, 2013, 1, 18601868
[5] Ming Jiang, Yan Wu, Yong He and Jun Nie. Micelles formed by self-assembly of hyperbranched poly[(amine-ester)-co-(D,L-lactide)](HPAE-co-PLA) copolymers for protein drug delivery. Polym Int 2009; 58: 31-39