引 言
本文描述的实验方法可以通过终点鲎试剂(Limulus amebocyte lysate, LAL)法实现定量分析纳米粒子中革兰氏阴性菌内毒素的含量。本法是根据Pirece公司的QCL-1000试剂盒以及美国国家药典(United State Pharmacopeia, USP)标准85“细菌内毒素检测”以及美国NCL提供的方法编写的[1-3]。亦可参照国家标准,对样品进行检测[4-6]。
鲎试剂法终点显色法定量检测纳米粒子中革兰氏阴性菌内毒素含量
Detection and quantification of gram negtive bacterial endotoxin
contamination in nanoparticle formulations by end point chromogenic
limulus amebocyte lysate(LAL) assay
1.原理
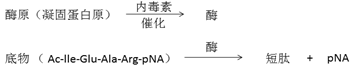
革兰氏阴性菌内毒素可与LAL中的一种酶反应,释放出黄色的p-硝基苯胺(p-nitroaniline, pNA)。加入冰醋酸或十二烷基硫酸钠(SDS)可以终止p-硝基苯胺的释放,底物可通过405nm的吸光度测量。样品中内毒素的浓度直接与吸光度是成比例的,可根据标准曲线计算出来。本检测方法大概需要1mg左右的纳米材料。
2.仪器与试剂
以下列出的产品供应商仅以提供产品信息为目的,可以由同类产品的其他供货商所替代。
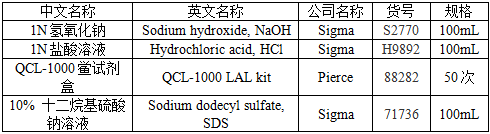
2.1 试剂
2.2 耗材
移液管(2mL,5mL,10mL)、96孔平底细胞培养板、一次性无内毒素玻璃管(12x75mm,ACC, TB240)、无热源离心管(15mL)
2.3 仪器
离心机、冰箱(4°C和-20°C)、生物安全柜(可处理生物相关材料)、涡旋混匀仪、酶标仪
3.试剂配制
3.1 氢氧化钠溶液(0.1N):使用无热源的水配制一定体积的0.1N NaOH溶液,使用无热源的离心管储存。
3.2 盐酸溶液(0.1N):使用无热源的水将HCl储存液稀释至0.1N,使用无热源的离心管储存仪器。
3.3 参考标准内毒素(RSE)储存液:试剂盒中提供的干粉状大肠杆菌脂多糖(E.coli lipophlusaccharide, LPS)是经过USP认证的参考标准内毒素(Reference standard endotoxin, RSE)。将其溶于1mL无热源水中,终浓度控制在15-40U/mL。实际浓度取决于每个试剂盒提供的分析证书上的数据。每次使用前,储存液需彻底混匀,并达到室温。
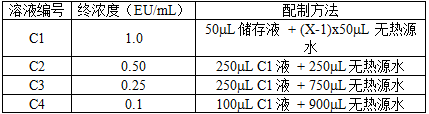
3.4 计算标液(C1-C4):下表为一系列不同浓度的计算标液配制的示例。各个标液的体积可根据实际需要进行调整。其中储存液为4.3中提及的RSE储存液,X为储存液的浓度。
3.5 质控标液(Q1):下表为一系列不同浓度的计算标液配制的示例。各个标液的体积可根据实际需要进行调整。其中储存液为4.3中提及的RSE储存液,X为储存液的浓度。纳米粒子溶液的浓度应与实验中待测样品浓度相当。

3.6 抑制或增强对照(IEC):下表为一系列不同浓度的计算标液配制的示例。各个标液的体积可根据实际需要进行调整。其中储存液为3.3中提及的RSE储存液,X为储存液的浓度。纳米粒子溶液的浓度应与实验中待测样品浓度相当。

4.样品制备
样品建议溶解于无热源的水中,或是无菌无热源的PBS中,终浓度为1.0mg/mL。使用0.1N NaOH或0.1N HCl调节样品溶液的pH值至6.0-8.0。为避免样品被pH电极污染,通常取出少量体积,使用pH试纸测试。如果样品溶于PBS中,则空白PBS也需在实验中进行检测
5.测量步骤
5.1 将上述配制好的溶液按照图1所示加入37°C预热的无菌96孔板中,每孔50mL。其中空白水对照4孔,其余对照及待测样品,每种溶液2孔。37°C培养5min。(加入前,彻底混匀所有的溶液)。
5.2 将LAL试剂加入到所有孔中,每孔50mL。轻轻摇动混匀,37°C培养10min。
5.3 将显色底物溶液加入到所有孔中,每孔100mL。轻轻摇动混匀,37°C培养6min。
5.4 将终止溶液(10% SDS)加入到所有孔中,每孔50mL。轻轻摇动混匀。
5.5 使用酶标仪读取405nm处的吸光度。
5.6 图1:96孔板加样图例。其中Q1为质控标液,C1-C4为计算标液,IEC为抑制/增强对照。

6.数据分析
6.1 变化系数百分比:CV% = SD/mean x 100,其中SD为标准偏差,mean为平均值。
6.2 理论误差百分比(Percent Difference from Theoretical, PDFT):PDFT =(RSE浓度计算值 - RSE浓度理论值)/ RSE浓度理论值 x 100%。
6.3 利用线性回归法做出标准曲线。
7.接受标准
7.1 对于每个对照组以及检测的样品,CV%和PDFT不能超过25%。
7.2 如果质控溶液没能达到上述接受标准,此检测需要重复。
7.3 标准曲线的相关系数不小于0.980。
7.4 如果标准曲线不能符合8.1和8.3的接受标准,此检测需要重复。
7.5 在本实验进行之前,应先检测待测样品本身是否在405nm有吸收。在96孔板中,加入50mL样品溶液,150mL无热源水和50mL终止溶液,不孵育,直接检测405nm处的吸光度。如果吸光度大于水的吸光度,则说明样品本身有吸收,需将本实验中“水”作为空白对照,改为“样品溶液直接混合终止溶液”为空白对照。
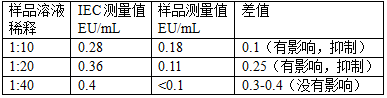
7.6 IEC的测量值与样品溶液测量值之间的差值应为0.4EU/mL±25%,即0.3~0.5EU/mL。如果差值在此范围以外,则该浓度的样品对内毒素检测是有影响的(抑制或增强)。则需要使用稀释法,对样品进行稀释后,再测量IEC。直到找到一个对内毒素检测无影响的合适的样品浓度。如下表示例。
7.7 美国食品药品管理局(Food and drug administration, FDA)批准了以下相关的上限标准:设备:0.5EU/mL,与脑脊液接触的设备为0.06EU/mL;非肠道药物:K/M。K为法定限制,5EU/kg。M为每小时最大的用药剂量;鞘内注射的非肠道药:K/M。K为法定限制,0.2EU/kg。M为每小时最大的用药剂量。如没有提供K/M值,纳米粒子相关配方将以设备标准为准。
8.缩略语
EU:内毒素单位(标准鲎试剂的最低促凝胶活性值定为内毒素单位1EU)
FBS:胎牛血清
LAL:鲎试剂
LPS:脂多糖
IEC:抑制/增强对照
min:分钟
PBS:磷酸缓冲盐溶液
PDFT:理论误差百分比
RSE:参考标准内毒素
SDS:十二烷基硫酸钠
USP:美国国家药典
v/v:体积比
9.参考文献
[1]Pierce® LAL Chromogenic Endotoxin Quantitation kit instruction (#88282), Thermo Fisher Scientific Inc.
[2]USP34-NF29. <85>. Bacteria Endotoxins. Rockville, MD: United States Pharmacopeia. (2011) 1: 78-81.
[3]Dobrovolskaia MA, Neun BW. NCL Method (2011) STE-1.1 (Version 1.2):1-10.
[4]ISO-29701纳米技术纳米材料体外内毒素试验鲎试剂(LAL)测定法(Nanotechnologies-Endotoxin test on nanomaterial samples for in vitro systems-Limulus amebocyte lysate(LAL) test).
[5]GB/T14233.2-2005,医用输液、输血、注射器具检验方法 第2部分:生物学试验方法。
[6]YY/T 1295-2015,医疗器械生物学评价 纳米材料:细菌内毒素试验。
国家纳米科学分析报告