引 言
支原体是一种无细胞核无细胞壁的细菌,因此可以不受很多抗生素的影响。支原体的存在,虽然不会直接杀死细胞,但是会影响细胞很多正常的生理功能,如细胞增殖、转化以及形态等。通常需要检测支原体污染的纳米粒子主要包括那些与来源于细菌培养物、动物或杂交瘤细胞的物质混合的纳米材料。
检测纳米粒子是否引入支原体的标准分析方法
Detection of mycoplasma
1.原理
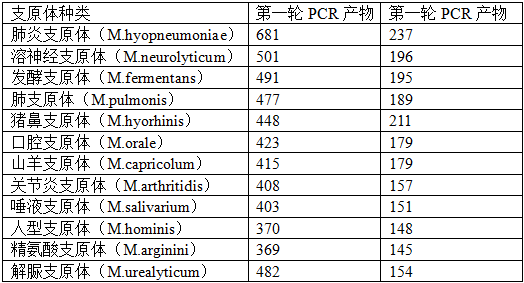
1.1 通常将细胞与纳米粒子混合24小时后,将细胞传代20次左右,通过聚合酶链式反应(Polymerase chain reaction, PCR)的方法检测细胞上清液是否含有支原体[1]。本法利用迈晨科技公司提供支原体检测试剂盒检测细胞上清液中的支原体污染情况。试剂盒中提供的引物均根据支原体基因组的保守区设计的,可以检测多种支原体(表2)[2]。
1.2 由于PCR方法易产生假阳性结果,因此本法还采用了另一种方法,即DNA染色法,对于PCR结果进行佐证[3]。DNA染色法,是利用荧光染料Hoechst33258(bisbenzimide)检测细胞培养过程中的支原体污染。荧光染料可有结合到DNA中碱基对A-T富集的区域,由于支原体DNA中碱基对A-T含量占多数(55~80%)。如果细胞培养存在支原体污染,那么加入染料染色后,通过荧光显微镜可以在细胞周围观测到雾状或者串珠状的亮点。
1.3 本法不能证明纳米材料中没有支原体,而只是确认纳米材料不会引起细胞培养以及体内或体外检测过程中支原体的污染。
2.仪器与试剂
以下列出的产品供应商仅以提供产品信息为目的,可以由同类产品的其他供货商所替代。
2.1 试剂
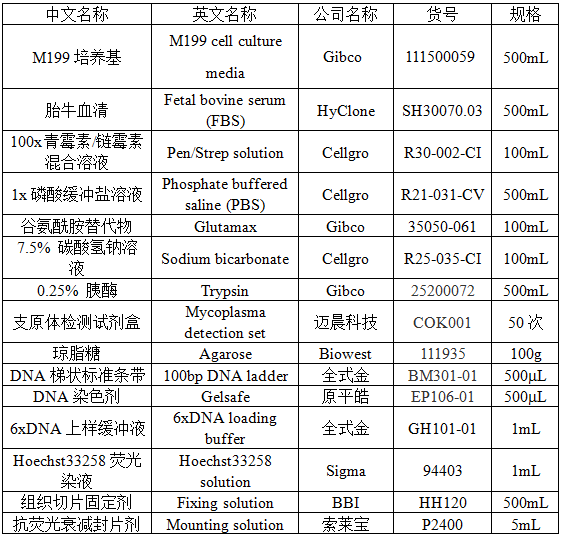
2.2 耗材
移液管(5mL,10mL)、35mm细胞培养皿、微量PCR管(0.2ml)、离心管(15mL),腔室培养皿(NUNC),盖玻片。
2.3 仪器
离心机、冰箱(4°C和-20°C)、细胞培养箱(37°C,5% CO2,95%湿度)、水平电泳仪、PCR仪、照胶仪(Biotop #SC805)、倒置荧光显微镜(Olympus IX71)
2.4 细胞系
LLC-PK1(猪的近端肾小管细胞系)
3.试剂配制
3.1 M199完全培养基(无菌):5% FBS(经过热灭活)、2 mMGlutamax、100U/mL 青霉素、100mg/mL 链霉素、500mL M199培养基、1.5 g/L to 2.2 g/L NaHCO3溶液。避光保存在2-8°C,不超过一个月。使用前,要37°C水浴中预热。
3.2 热灭活FBS:在2-8°C解冻一瓶FBS,热灭活前恢复至室温。放入56°C水浴中30min,并且每隔5min混匀一次。根据每次实验的用量(~50mL),分装后保存在-20°C。每次使用前,在2-8°C解冻。剩余FBS可在2-8°C保存一个月。
3.3 Hoechst33258工作液:无菌条件下将1mg/mL的Hoechst 33258储存液用1xPBS缓冲液稀释至1μg/mL,避光保存。
4.样品制备:纳米粒子溶液的配制
4.1 将银纳米粒子完全溶解在2mL完全细胞培养基中,终浓度一般为1mg/mL。
4.2 选择合适的纳米粒子溶液的浓度时,必须考虑以下几个问题:
(1)纳米粒子在某种生物相容性缓冲液中的溶解度。
(2)生理条件下的pH值。
(3)纳米粒子的可用性及稳定性。如果1mg/mL的浓度不适合,需要对此浓度进行调整,一定要在适合的浓度下分析样品。
5.实验步骤
5.1 PCR检测
5.1.1 在35mm细胞培养皿中培养细胞,细胞密度达到50-60%。
5.1.2 弃去原培养基。加入含有纳米粒子的完全培养基1mL,继续培养24小时。
5.1.3 弃去原培养基,加入新鲜的完全培养基2mL,继续培养4-6小时。
5.1.4 细胞正常传代,在传至第1代、5代、10代,细胞密度达到90%以上,收集1mL上清液。并将部分细胞传代至腔室培养皿中,用于DNA染色检测(5.2)。
5.1.5 高速离心上清,13000rpm,4°C,10min。
5.1.6 弃去约980mL上清,剩余约20mL上清重悬混匀。取1mL作为后面PCR的模板。
5.1.7 进行PCR操作。两轮PCR的反应体系和反应程序如下(表1)。
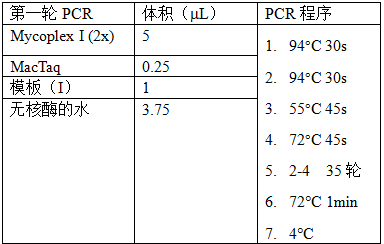
模板(Ⅰ)为5.16中的重悬培养基或试剂盒提供的阳性对照。
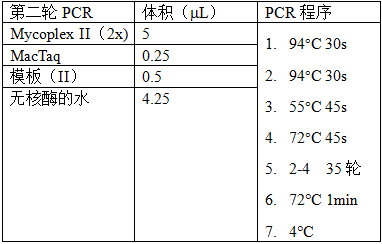
模板(Ⅱ)为第一轮PCR产物。
5.1.8 将5mL PCR产物进行琼脂糖凝胶电泳,1.2-1.5%琼脂糖胶。(如果第一轮产物电泳后发现,已经扩增出条带,说明支原体污染很严重,则不必进行第二轮PCR。)可能扩增产物的片段大小及对应支原体名称如表2。
5.2 DNA染色检测
5.2.1 在腔室培养皿中培养1天,至细胞密度达到70-80%。
5.2.2 弃去上清,加入0.2mL固定液,静置20min。吸去固定液,风干10min。
5.2.3 于每孔中,加入0.2mL的Hoechst33258工作液覆盖全部被检细胞37°C,15~20min(或室温静置20~30min)。
5.2.4 吸去Hoechst33258工作液,直接风干。风干后加入一滴封固液,并以盖玻片覆盖。
5.2.5 用100-400x荧光显微镜(UV激发光330-380nm,吸收光420-480nm的滤光镜)观察并拍照。,观察细胞周围是否有蓝色荧光小点或串珠状小点的荧光。
6.接受标准
6.1 待测培养基第一轮和第二轮PCR扩增产物的电泳结果,如果有条带,说明细胞培养过程中引入了支原体污染。
6.2 如果第一轮PCR扩增产物的电泳结果,就有条带,说明支原体污染严重。如果只是第二轮PCR扩增产物的电泳结果有条带,则说明支原体轻度污染。
6.3 DNA染色的结果,需观察染色的细胞。如细胞周围是否有蓝色荧光小点或串珠状小点的荧光。则说明有支原体污染。
7.缩略语
FBS:胎牛血清
min:分钟
PBS:磷酸缓冲盐溶液
PCR:聚合酶链式反应
s:秒
8.参考文献
[1]Mycoplasma detection set (#COK001), 迈晨科技有限公司.
[2]Detection of mycoplasma. NCL Method (2011) STE-3 (Version 1.1):1-2.
[3]YoungL, SungJ, StaceyG,MastersJR.Detectionof mycoplasmain cell cultures. (2010) 5:929-934.
国家纳米科学中心分析报告