引 言
所有静脉注射的药物都必须评估其潜在的溶血性。体内溶血(血红细胞破裂)会导致贫血、黄疸和其他病理情况。
纳米粒子溶血活性检测
Analysis of hemolytic properties of nanoparticles
1.原理
本文采用定量比色法测定血液接触纳米粒子后,全血中血红蛋白(total blood hemoglobin, TBH)和释放到血浆中的自由血红蛋白((plasma free hemoglobin, PFH)的含量[1-4]。血红蛋白及其诱导剂,除硫血红蛋白外,血红蛋白在强碱中会被铁氰化物氧化为高铁血红蛋白。高铁血红蛋白再与氰化物(Drabkin’s溶液)继续反应会生成氰化正铁血红蛋白。分光光度计在540nm处可检测到氰化正铁血红蛋白。用血红蛋白标准品建立标准曲线,浓度范围从0.025至0.80mg/mL,并制备低(0.0625mg/mL)、中(0.125 mg/mL)、高(0.625mg/mL)三个浓度的质量控制样品来监测实验。实验结果表示为溶血百分比,可以用来评估纳米粒子的体外急性溶血性质。溶血活性检测也可按照国家标准[5-7]进行。
2.仪器与试剂
以下列出的产品供应商仅以提供产品信息为目的,可以由同类产品的其他供货商所替代。
2.1 试剂

2.2 耗材
移液管(2mL,5mL,10mL)、96孔平底细胞培养板、离心管(15mL)
2.3 仪器
37℃水浴、离心机、酶标仪
3.试剂配制
3.1 血红蛋白Hb标准储液(1.6mg/mL)的制备(配制5mL体系)
称取1.6×5=8.0mg(0.008g)血红蛋白粉末,直接溶于5ml 1×DPBS中,混匀,4℃避光保存。(直接称入离心管中,免去使用称量纸以防引入杂质)
3.2 氰化正铁血红蛋白(Cyanmethemoglobin, CMH)试剂:
将1瓶Drabkin’s 试剂溶于1000mL水中,然后加入0.5mL 30% Brij 35溶液,混匀备用。
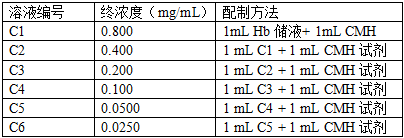
3.3 标液的制备:参照表1制备一系列标液,根据需要制备所需体积。
表1 标液的制备(Hb储液浓度为1.6mg/mL)
3.4 质量控制溶液的制备:参照表2制备质控溶液,根据需要制备所需体积。
表2 质控溶液的制备
3.5 阳性对照的制备(Positive control,PC):将多聚L-赖氨酸粉末溶于无菌蒸馏水中,终浓度为1%(10mg/mL)。分装后,保存于-20℃。
3.6 阴性对照的制备(Negative control,NC):购买的聚乙二醇已经是40%水溶液,使用该溶液作为阴性对照,保存于4℃。
4.样品制备:纳米粒子溶液的配制
本实验需要溶解/重悬于1xDPBS的浓度为9倍最高检测浓度纳米粒子溶液1.0mL(9x)。纳米粒子的检测浓度需根据预期的治疗浓度来选择。如果预期的治疗浓度为0.1mg/mL,纳米粒子的最高检测终浓度应为10mg/mL(即高于预期治疗浓度100倍以上)。如果纳米粒子的溶解度不允许检测100倍浓度,则选择预期治疗浓度的30倍作为最高终浓度。由于在检测管中纳米粒子会以1:9的比例被稀释,因此为了达到10mg/mL的最高终浓度需要制备90mg/mL的储液。理想情况下,纳米粒子的浓度应以活性成分(活性药物成分,active pharmaceutical ingredient, API)的量来表示。如果不知道活性成分的浓度,可以用总成分的重量来表示。当不清楚预期治疗浓度时,使用1mg/mL或最高可行浓度作为最高终浓度,或根据实际情况确定最高浓度。
如最高检测终浓度为1mg/mL,则需制备9mg/mL的储液和2-3个连续稀释的浓度,稀释比例根据样品的实际情况确定。如按照1:5连续稀释,则还需准备1.8、0.36和0.072mg/mL的溶液。在检测管中加入0.1mL样品以及0.7mLPBS和0.1mL血液,则实验检测的纳米粒子的最终浓度为1.0、0.2、0.04和0.008mg/mL。每个浓度的样品检测4个0.1mL的平行测定(其中1个为无血细胞内参)。
5.实验步骤
5.1 用含有肝素锂作为抗凝血剂的采血管收集至少三名捐献者的全血。血液可在2-8°C中保存48h。实验当日将不同捐献者的血液等体积混匀制备混合血液。
5.2 从混合血液中取出2-3mL,800xg离心15min。
5.3 收集上清(血浆)。在室温中制备标液、质量控制溶液及全部血红蛋白样品。收集的样品用来确定血浆中的游离血红蛋白(PFH)。
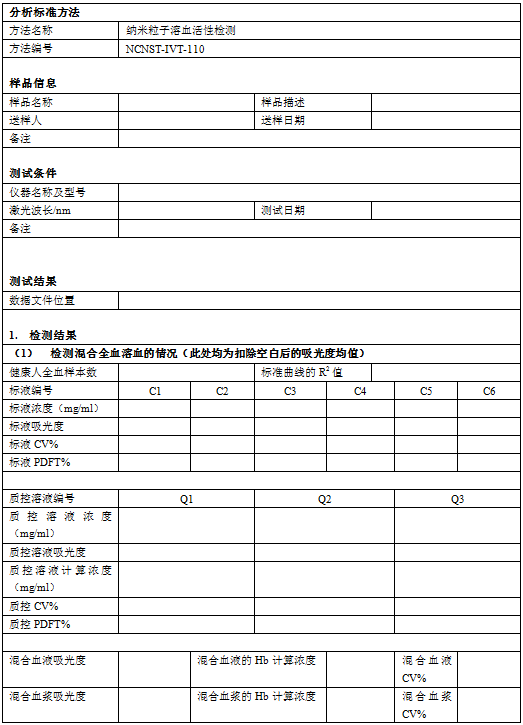
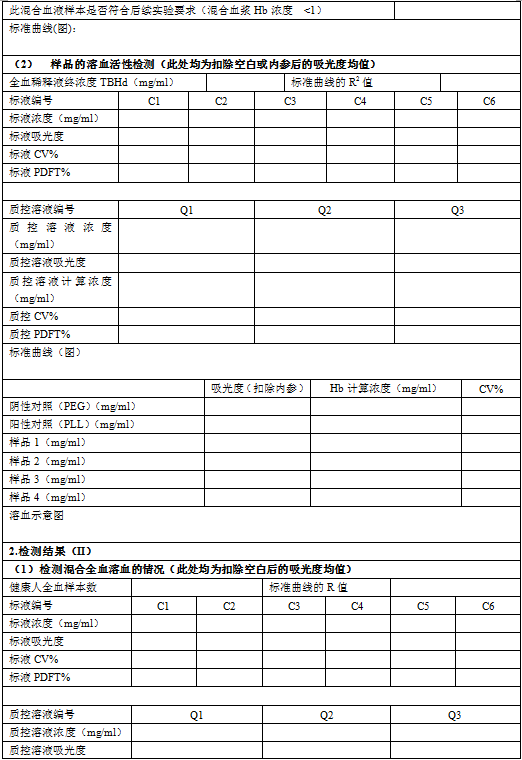
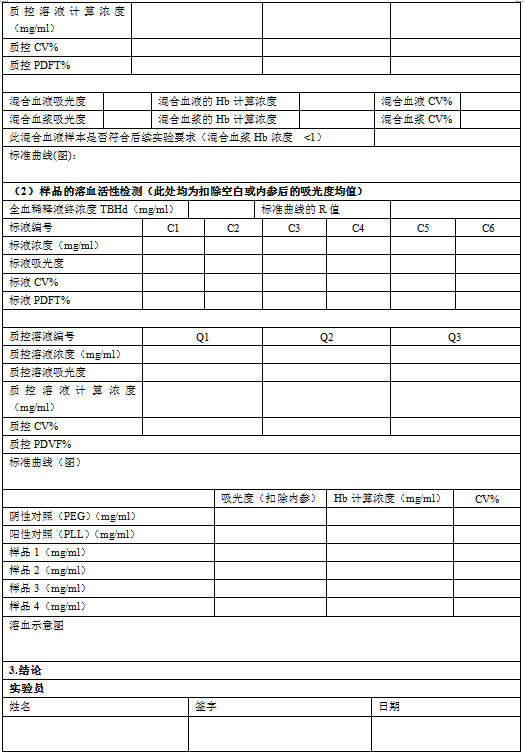
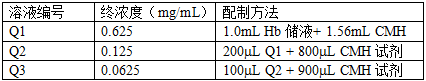
5.4 向96孔板每孔中加入200μL标液、质控溶液和空白氰化正铁血红蛋白(CMH)试剂,每种标液(C1-C6)加3孔,每种质控溶液(Q1-Q3)和空白加3孔。(见图1)
5.5 将20μL全血和5mLCMH试剂混合,作为全血红蛋白(TBH)样品,每孔加入200μL该样品,共加6个孔。
5.6 在96孔板中每孔加入100μL血浆(PFH),共加6个孔。
5.7 在每个样品孔中加入100μLCMH试剂。(在含有标液、质控溶液和TBH的孔中不加CMH试剂。)
5.8 盖上盖子,在振荡器上轻轻振荡,20℃,1000rpm,20min(振荡器速度设置应保证混合充分,但避免液体溢出造成交叉污染)。
5.9 在540nm处读取吸光度值来计算血红蛋白的浓度。计算PFH浓度时记得乘以稀释倍数2,而TBH的稀释倍数是251。如果计算PFH的浓度低于1mg/mL,那么开始进行下面的步骤。
5.10 用无Ca2+/Mg2+的DPBS稀释混合全血调整TBH浓度至10±2 mg/mL(TBHd)。
5.11 在EP管中加入100μL待测样品、空白(例如用来重新溶解待测样品的缓冲液)、阳性或阴性对照。每个未知样品制备4管(3管平行,1个内参)、空白3管(2管平行,1个内参)、阳性对照3管(2管平行,1个内参)、阴性对照3管(2管平行,1个内参)。(如果样品体积少于100μL,用无Ca2+/Mg2+的DPBS补足。)
5.12 每管中加入700μL无Ca2+/Mg2+的DPBS。
5.13 除1个待测样品管外,在每个EP管中加入100μL 6.10中制备的全血。在未加全血的1个待测样品管中,加入100μL无Ca2+/Mg2+的DPBS,相当于“阴性血”的对照,用来评估纳米粒子对该检测的干扰(如在540nm或附近波长的吸光度,与CMH试剂的反应等)。
5.14 盖上EP管,轻轻旋转混匀。(避免涡旋混匀,可能会损害红细胞。)
5.15 将EP管在37℃水浴中孵育3h±15min,每30min混合样品一次。也可在37℃恒温箱中旋转孵育。
5.16 将EP管移出水浴或恒温箱。如果使用的是水浴,则需用吸水纸将多余的水擦干。
5.17 室温离心,800xg,15min。(离心结束后检查EP管并记录异常现象用来解释实验结果,如图2。)
注意:如果纳米粒子在540nm或附近波长有吸光度,那么需要在进行下一步之前从上清液中除去纳米粒子。例如,10-50nm胶体金纳米粒子在535nm处有吸收。6.17结束后,将上清转移至新的EP管中,1800xg,离心30min。从上清中除去不同纳米粒子的方法是不同的,需要经过合适的实验验证现有的分离纳米粒子的方法是否会对实验产生影响。在特定情况下,除去纳米粒子是不可行的。在这种情况下,需将纳米粒子与血液孵育所得的结果减去相同粒子与“阴性血”对照(见6.13)共同孵育所得的结果。图4和图5显示了干扰的例子及除去干扰的方法。
5.18 制备一系列新鲜的标液和质控溶液。
5.19 在一块新的96孔板中,每孔加入200μL空白试剂、标液、质控溶液和TBHd(400μL 6.10中的血液和5mLCMH试剂混合)。每种标液(C1-C6)加3孔,每种质控溶液(Q1-Q3)和空白加3孔,TBHd样品加3孔。(见图2)。
5.20 每孔加入100μL待测样品、6.17中制备的阳性和阴性对照。每个待测样品加12个孔(6.11中4个待测样品管,每管加3孔),空白(PBS)、阴性对照和阳性对照均加9个孔(3个对照管,每管加3孔)。
5.21 向每个含有待测样品和对照的孔中加入100μL CMH试剂。(在含有标液、质控溶液和TBHd的孔中不加CMH试剂。)
5.22 盖上盖子,在振荡器上轻轻振荡,C,20min,1000rpm(振荡器速度设置应保证混合充分,但避免液体溢出造成交叉污染)。
5.23 读取540nm处的吸光度值来计算血红蛋白的浓度。计算待测样品、对照的浓度时需乘以稀释倍数2,TBHd的稀释倍数是13.5。
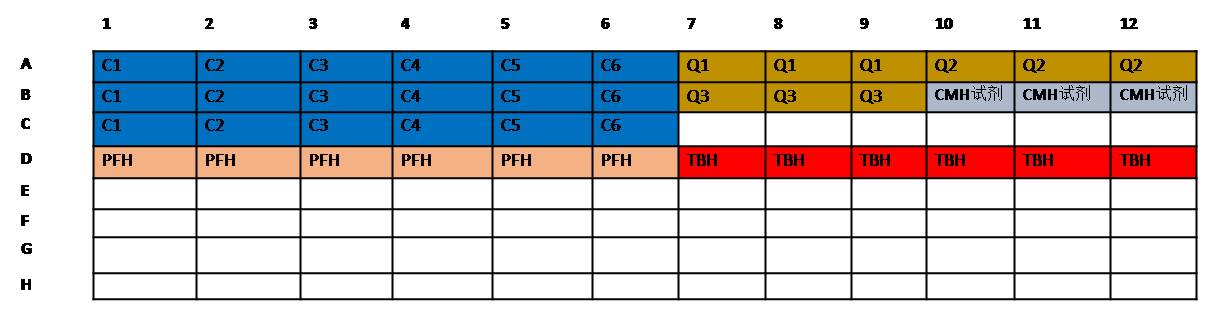
图1:全血稀释前测定血红蛋白的加样图例。
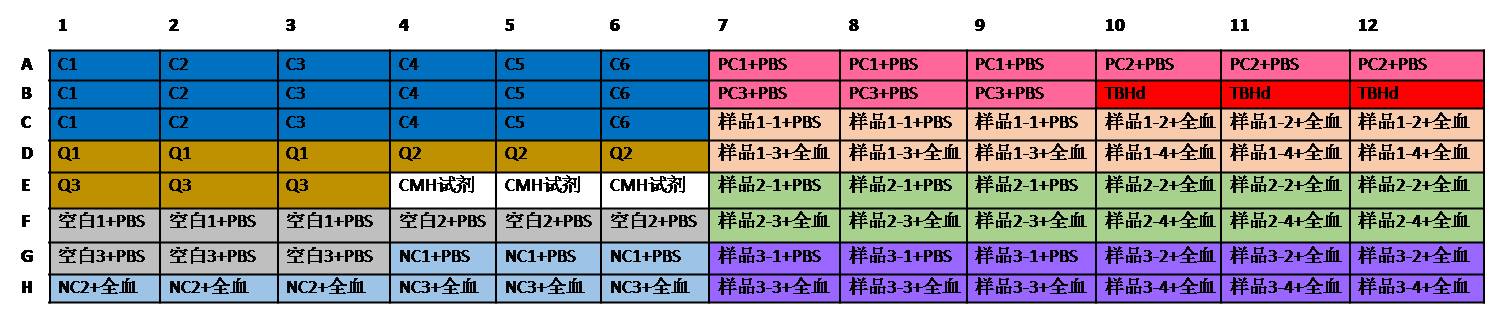
图2:全血稀释后测定血红蛋白的加样图例。空白-PBS,NC-阴性对照,PC-阳性对照;样品1-4分别为不同稀释倍数的样品溶液。
6.数据分析
使用四参数回归算法建立标准曲线。每个标液和质控溶液需要计算下列参数:
6.1 溶血百分比hemolysis%=( )
6.2 变化系数百分比(Percent coefficient of variation,CV%):
CV%=SD/平均值×100,其中SD为标准偏差。
需计算每个空白、阳性对照、阴性对照和待测样品的CV%。
6.3 理论误差百分比(Percent Difference from Theoretical,PDFT):

7.接受标准
7.1 每个标液和质控溶液的CV%和PDFT应该小于30%。C6可接受的范围为40%。如果2/3的质控溶液以及每个质控溶液中至少一个数值在接受范围内,则本次实验可被接受。否则,本次实验需要重做。
7.2 所有阳性对照、阴性对照和待测样品的CV%应该小于30%。阳性对照和阴性对照中至少一个平行测定可被接受,则本次实验才被接受。
7.3 如果阳性对照或阴性对照的两个平行测定均不能达到8.2所述的接受标准,则本次实验需重做。
7.4 在结果可接受的实验中,如果待测样品中的两个或三个平行测定不能达到8.2所述的接受标准,则该待测样品需要重新检测。
8.纳米粒子干扰示例及处理方法
8.1 离心后记录样品表象以免出现假阴性结果。(图3)
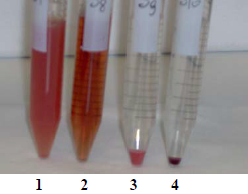
图3:上图所示,通过观察上清颜色可以看出,20nm粒径的聚苯乙烯纳米粒子(管1)和50nm粒径的聚苯乙烯纳米粒子(管2)的具有溶血活性。80nm粒径的聚苯乙烯纳米粒子(管3)也有溶血。但是从沉淀的大小和颜色可以看出,此种纳米粒子会吸收血红蛋白。因此,在540nm处检测样品上清会出现阴性结果。管4是阴性对照。从上清中观察无溶血活性,完整的红细胞在管底形成了紧实的暗红色沉淀。
8.2 纳米粒子在检测波长处有吸收而造成假阳性结果。(图4-5)
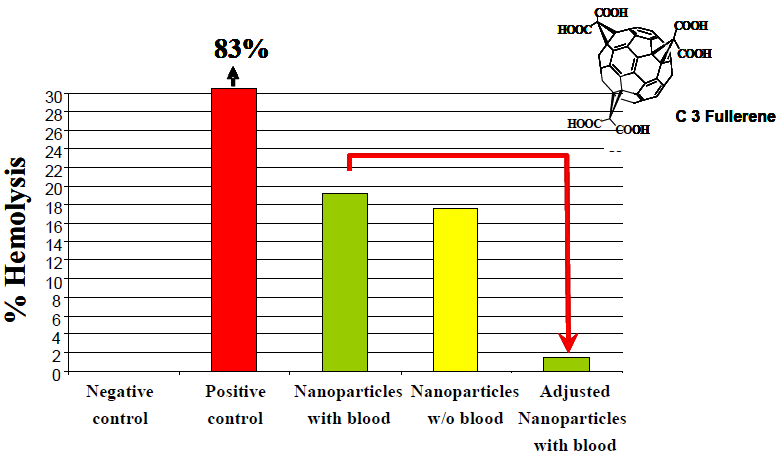
图4:由于尺寸较小,富勒烯碳纳米粒子无法从上清中除去。因此,需要减去纳米粒子的干扰来校准结果。
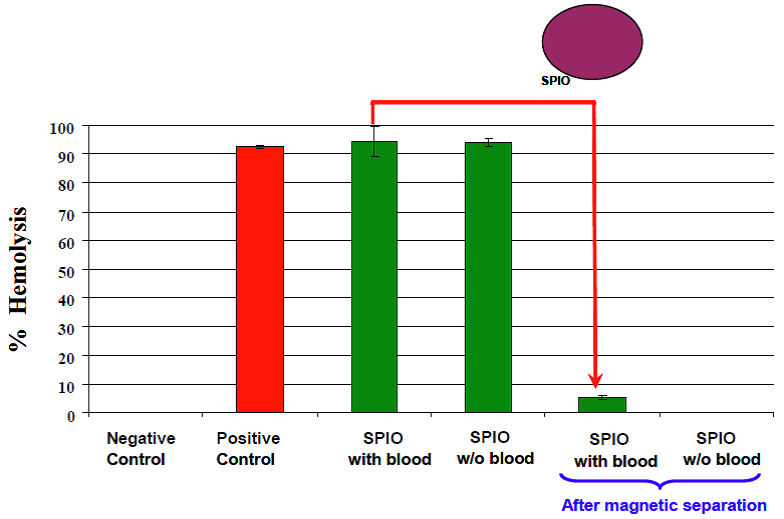
图5:为了从上清中除去氧化铁纳米粒子,装有上清的EP管需在磁铁上4°C孵育过夜。粒子集中于靠近磁铁的一侧,这种方法可从上清中除去游离的纳米粒子,以便于检测。
9.缩略语
API:有效药物成分
Ca:钙
CMH:氰化正铁血红蛋白
CV:变化系数
min:分钟
PBS:磷酸缓冲盐溶液
h:小时
Li:锂
Mg:镁
RT:室温
s:秒
SPIO:超顺磁氧化铁
TBH:全血血红蛋白
TBHd:稀释的全血血红蛋白
10.参考文献
[1]ASTM standard practice F 756-00. Assessment of hemolytic properties of materials.
[2]DeSilva B, Smith W, Weiner R, Kelley M, Smolec J, Lee B, Khan M, Tacey R, HillH, Celniker A. Recommendations for the bioanalytical method validation of ligandbindingassays to support pharmacokinetic assessments of macromolecules. Pharm.Res. (2003)11:1885-1900.
[3]Bioanalytical method validation. Guidance for industry.FDA/CDER/CVM. (2001) BP.
[4]Dobrovolskaia MA, Neun BW.Analysis of hemolytic properties of nanoparticles. NCL Method ITA-1 (2009) (Version 1.1) 1-15.
[5]GB/T 16175-1996,医用有机硅材料生物学评价试验方法.
[6]GB/T16886.4-2003/ISO 10993-4:2002,医疗器械生物学评价 第4部分 与血液相互作用试验选择.
[7]GB/T14233.2-2005,医用输液、输血、注射器具检验方法 第2部分:生物学试验方法.
国家纳米科学中心分析报告