引 言
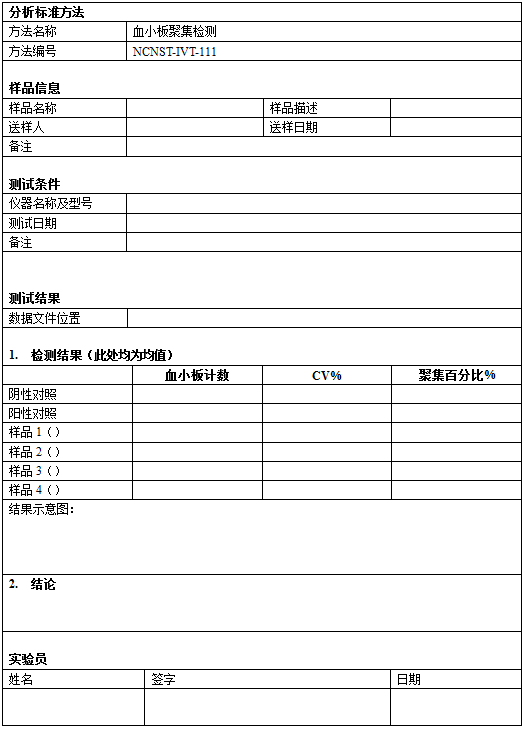
本文描述了一种检测血小板凝集的方法[1-7]。血小板是一种由巨核细胞裂解形成的小的(~2μm)无核细胞。血小板还在止血过程中起重要作用。血小板数量和功能的异常可能导致出血或血栓。体外检测纳米粒子对人血小板的影响可以快速筛查出它们潜在的抗凝血或促血栓形成的活性。
血小板聚集检测
Analysis of platelet aggragation
1.原理
将来自于新鲜的混合人全血的富含血小板的血浆(platelet-rich plasma,PRP)与对照组或检测样品一同孵育。之后,用分析仪确定PRP中活性血小板的数量。通过比较待测样品和对照组中活性血小板的数量来计算凝集比例。根据样品的不同,也可按照参考文献[8]进行检测。
2.仪器与试剂
以下列出的产品供应商仅以提供产品信息为目的,可以由同类产品的其他供货商所替代。
2.1 试剂
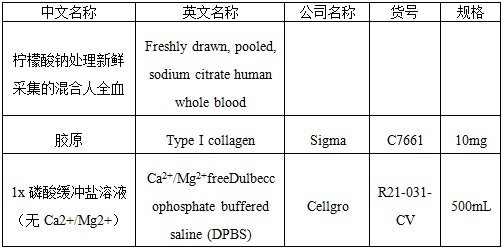
2.2 耗材
量程包括0.02至1mL的移液器、离心管15mL、1.5mL EP管
2.3 仪器
37℃水浴、200xg离心机、全自动血液分析仪(Sysmex XS-800i,日本希森美康)
3.样品制备
本试验中每种浓度的纳米粒子溶液需要130mL,浓度为最终检测浓度的5倍(5x)。纳米粒子溶解或重悬于1xDPBS或其他不干扰血小板聚集的无血清培养基中。
检测浓度需根据纳米粒子预期的治疗浓度来选择。如果预期的治疗浓度是0.1mg/mL,那么最高的检测弄高度即为10mg/mL(即高于预期治疗浓度100倍)。如果粒子的溶解度不允许检测100倍浓度,那么就检测最高检测浓度可以是预期治疗浓度的30倍。
例如,要达到10mg/mL的最高检测浓度,就需要准备浓度为50mg/mL的纳米粒子储液,以便在检测管中1:5稀释。纳米粒子的浓度最好由活性药物成分(active pharmaceutical ingredient,API)的量来表示。在不知道活性成分浓度的情况下,可以用总成分的重量来代替。在不知道预期治疗浓度的情况下,最高检测浓度定为1.0mg/mL,或最高可行浓度。本实验共验检测纳米粒子的四个浓度:最高浓度及三次1:5连续稀释的样品。例如,最高检测浓度为1.0mg/mL,就需要浓度为5.0mg/mL的储液。三次1:5连续稀释该样品得到浓度为1.0、0.2和0.04mg/mL的样品。每个检测浓度需要5个25mL的平行测定(n=5),其中2个平行作为内参(即用1xDPBS替代血浆)。当检测管中分别加入每种浓度的0.025mL检测样品和0.1mL富含血小板血浆后,实验最终的检测浓度为1、0.2、0.04和0.008mg/mL。
4.实验步骤
4.1 将所有的架子、管子以及溶液置于室温(较低温度(﹤20℃),否则会导致血小板凝集)。
4.2 将新鲜采集的全血200xg离心8min,制备富血小板血浆(PRP)。在进行下一步之前将至少3名捐献者的PRP混合在一起。
重要注意:A) 收集血液的过程中,最初的2mL血液应被弃去,这样是为了避免由静脉穿刺引起的血小板刺激。B) PRP必须在血液采集后的1h之内制备。PRP须室温保存,并于制备后4h之内使用。C)血液或PRP应避免被置于较低温度(﹤20℃),否则会导致血小板凝集。
2)100μL PRP和阳性对照(1mg/mL 胶原,溶解于0.1N乙酸中)(2个平行);
3)100μL PRP和25μL阴性对照(1x DPBS)(2个平行)。
这三个样品将提供待测纳米材料导致血小板聚集能力的检测数据。
B)在1.5mL EP管(内参管)中混合:
100μL 1xDPBS和25μL待测样品溶液(2个平行)。
5.数据分析
每个对照及待测样品均需计算下列参数:
5.1 变化系数百分比(Percent coefficient of variation,CV%)
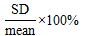
5.2 血小板计数=R×109个/L
5.3 血小板聚集百分比(Percent platelet aggregation,PA%)

6.接收标准
6.1 每个对照及待测样品的CV%都应在25%之内。
6.2 如果阳性对照或者阴性对照的平行测定不能达到6.1的标准,实验需要重新进行。
6.3 在合格的检测中,如果未知样品不能达到6.1的标准,该样品需要重新进行分析。
6.4 此检测方法的阈值是20%。血小板凝集百分比高于20%,则认为是阳性结果,即待测样品会导致血小板凝集。
7.缩略语
API:活性药物成分
CV:变化系数
h:小时
min:分钟
PBS:磷酸缓冲盐溶液
PRP:富血小板血浆
SD:标准偏差
8.参考文献
[1]Bioanalytical method validation. Guidance for industry. FDA/CDER/CVM. (May 2001) BP.
[2]Wu KK, Hoak JC. A new method for the quantitative detection of platelet aggregates in patients with arterial insufficiency. Lancet (1974) 2(7886):924-926.
[3]Born GVR. Aggregation of blood platelets by adenosine diphosphate and its reversal. Nature, (1962) 194:927-929.
[4]Leoni P, Rupoli S, lai G, Brunelli MA, Belmonte MM, Pugnaloni A, Rabini RA, Mazzanti L, Biagini G. Platelet abnormalities in idiopathic myelofibrosis: functional, biochemicalandimmunomorphological correlations. Hematologica (1994) 79:29-39.
[5]Balakrishnan B., Kumar DS., Yoshida Y., Jayakrishnan A. Chemical modification of poly (vinyl chloride) resin using poly(ethylene glycol) to improve blood compatibility. Biomaterials, (2005) 26:3495-3502.
[6]Oyewumi MO., Yokel RA., Jay M., Coakley T., Mumper RJ. Comparison of cell uptake, biodistribution and tumor retention of folate-coated and PEG-coated gadolinium nanoparticles in tumor-bearing mice. J. Controlled Release, 2004; 95: 613-626.
[7]Dobrovolskaia MA, Neun BW. Analysis of platelet aggregation. NCL Method ITA-2 (2009) (Version 1.1) 1-8.
[8]GB/T 16886.4-2003/ISO 10993-4:2002,医疗器械生物学评价 第4部分 与血液相互作用试验选择.
国家纳米科学中心分析报告