



引 言
由于纳米材料具有特殊的性质,如较高的表面自由能,当纳米材料进入生物体后极易吸附生物体液中的生物分子。特别是一些蛋白质可结合在纳米材料表面形成冠状蛋白质层(protein corona)。冠状蛋白质层在一定程度上可改变纳米材料的生物学特征,生物体对纳米材料的进一步响应也与冠状蛋白质层的复杂程度相关[1]。而纳米材料的组成成分,表面理化性质,颗粒直径都会影响其表面冠状蛋白质层的组成[2]。一般情况,表面带电的纳米颗粒较中性的纳米颗粒能结合更多的蛋白质,这些结合的蛋白质是影响免疫系统的吞噬细胞摄取纳米颗粒的关键因素之一,同时也影响纳米粒子在生物体中的分布[3](图1)。
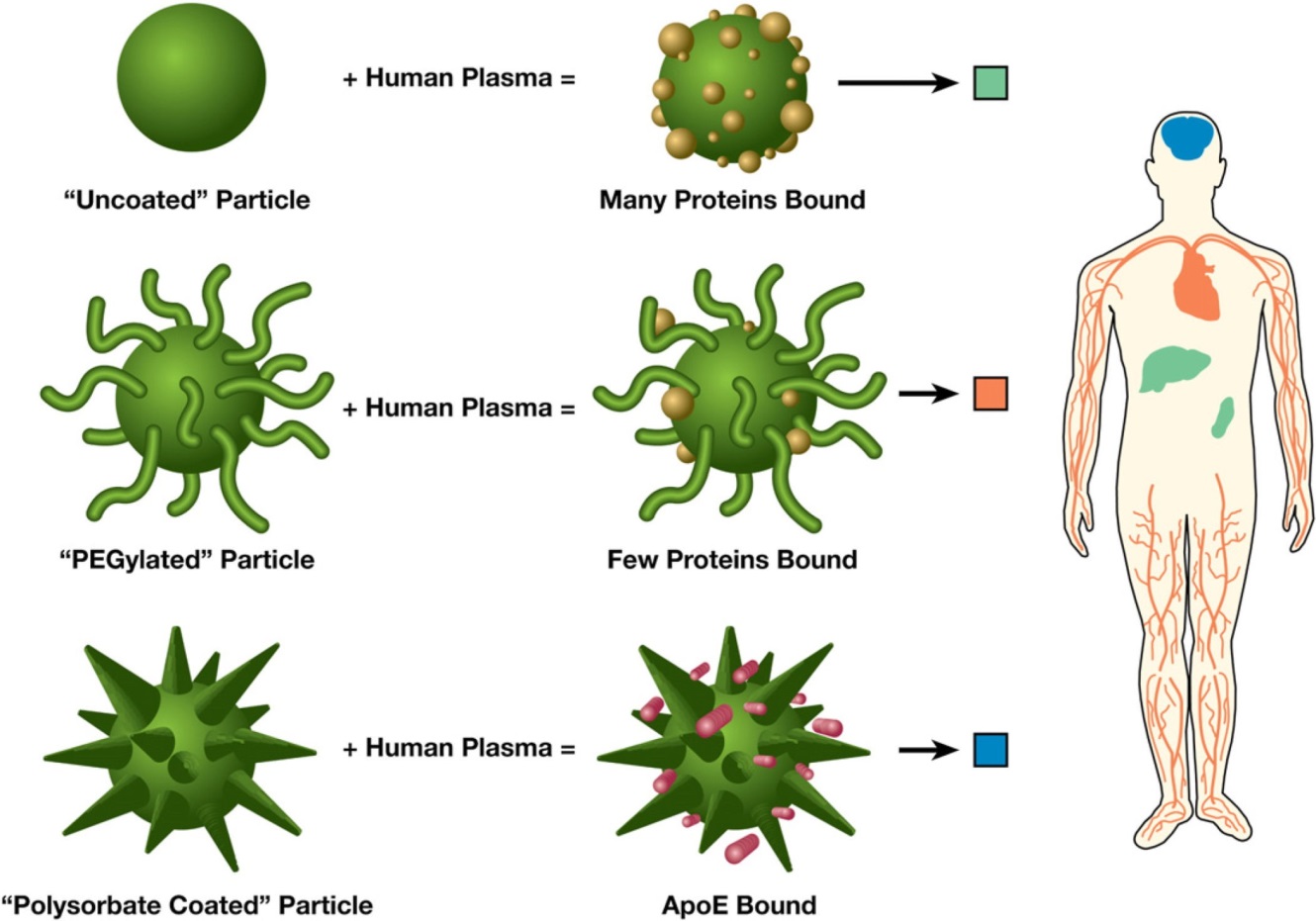
图1. 纳米粒子表面特性如何影响蛋白质的结合
不同表面性质的纳米颗粒结合血浆中的蛋白种类差异,影响其稳定性,生物体中的分布以及从血液中清除的速率。
使用Lable Free Quantitative Method (LFQ) 分析纳米颗粒在血浆中的相互作用蛋白
Analysis of nanoparticle interaction with plasma proteins
by label-free quantitative method
1.原理
本文描述了使用非标记定量方法(LFQ)分析纳米颗粒与血浆蛋白相互作用。首先纳米颗粒与混合的来源于健康的捐赠人的血浆孵育,完成血浆中蛋白的吸附。之后纳米材料的冠状蛋白质层通过分离洗脱,使用LC-MS/MS进行鉴定以及定量[4-6]。此分析方法需要至少1mg的纳米颗粒,以及1mL的混合血浆。
2.仪器与试剂
注意:下面列出的供应商仅供参考,但要实验过程中求使用低吸附的材料。
2.1 试剂
正常人血浆(取材>3人),抗凝剂EDTA、纳米粒子、PBS,不含Ca/Mg离子、无菌水、2D Quant Kit(GE Healthcare)、Dithiothreitol (DTT) (Amresco)、Iodoacetamide(IAA)(Amresco)、Ammonium bicarbonate(Sigma)、Trypsin,测序级(Promega)、乙腈(ACN),HPLC级 (Fisher)、三氟乙酸(TFA),HPLC级(Sigma)、Tris base(Amresco)、Urea(Amresco)、CHAPS(Sigma)、甲酸,质谱级(Sigma)。
2.2 耗材
移液器吸头0.01 to 1mL (Axygen)、C18 Zip Tip (MILLIPORE)、低吸付离心管0.6/1.5 mL (Axygen)、15 mL离心管 (Costar)、自动进样器适用进样瓶 (Thermo)
2.3 仪器
离心机、37ºC温箱、水浴锅、Q Exactive质谱仪(Thermo Scientific)、旋转混匀仪、EASY-nLC (Thermo Scientific)、抽干机
3.试剂配制
3.1 裂解液:200mL,50mM Tris-Cl,8 M Urea,2%CHAPS,1%DTT。
3.2 酶解缓冲液:50mM NH4HCO3。
3.3 脱盐溶液:A液100% ACN 0.1% TFA、B液1% ACN 0.1% TFA、C液 70% ACN 0.1% TFA。
4.样品制备
4.1 吸取1.5mL的混合血浆(约70-100mg的总蛋白)到离心管中。4℃,22,000g离心30分钟,收集上清,转移到新管。
4.2 将1mL纳米材料(1mg/mL)与1 mL离心过的血浆将混合,制备“+NP”样品,同时准备两组对照:1)将1mL纳米材料(1mg/mL)与1mL PBS混合(CON);2)将制备纳米材料的缓冲液与1mL离心过的血浆将混合(-NP)。如果纳米材料(1mg/mL)会产生聚集,可以将样品分为几份,在后续步骤中合并检测。例如使用三个样品浓度为0.333mg/mL的胶体金纳米颗粒,按此步骤进行样品制备,到(步骤4.8)将从三个管子样品合并,再进行后续洗脱步骤。
4.3 使用旋转混合仪37℃孵育样品30-35min。
4.4 22,000g,4℃离心for 10min,弃上清。
4.5 每样品加入1.5mL PBS,混合重悬后重复步骤4.4。
4.6 重复步骤4.5三次。
4.7 每个样品中加入 1.5 mL 0.1 x PBS (1:10用水稀释),混合重悬后,22,000 g, 4ºC 离心for 15 min,弃上清。
4.8 加入50 uL 裂解液,室温震荡超声约15-20 min。
4.9 22,000g 4ºC离心20 min。取上清到另一离心管中。此时样品可以-80ºC保存。离心力需根据材料性质进行调节,可适当增加转速。
5.样品浓度测定与酶解
5.1 2D Quant Kit测定样品中的蛋白浓度,具体步骤参考试剂盒说明。
5.2 每样品中加入50μL IAA(20mg/mL 用50mM NH4HCO3溶解),室温避光反应30-40min。
5.3 视+NP样品中蛋白含量, 以1:50-1:100 (m/m)加入Trypsin到各个样品中,37ºC 孵育过夜(12-16 h)。
6.样品脱盐
6.1 样品酶解完成后加入1% TFA (终体积) 终止反应。
6.2 C18 Zip Tip A液吹吸3次 (10uL/次)。
6.3 B液吹吸3次(10uL/次)。
6.4 反复吸取样品溶液。例如每次吸取10uL后将溶液打入另一离心管,如此反复直到所有样品都被转移到另一管中,酶解后的肽段即结合在C18 Zip Tip上。
6.5 B液吹吸3次(10uL/次)。
6.6 反复吸取转移50uL C液,洗脱C18 Zip Tip上的肽段,收集转移后的C液。
6.7 真空抽干样品,此时样品可以 -80ºC保存。
7.质谱检测
7.1 使用10uL 0.2% FA溶液溶解抽干后样品,超声1min,4ºC 20,000 g离心5 min,取上清加入到进样瓶中。
7.2 EASY-nLC A相 5% ACN 0.1%FA,B相80% ACN 0.1% FA,梯度设定:
0-10min B相 0% 到10%
11-220min B相11%-45%
221-235min B相 46%-100%
236-240min B相 100%
7.3 每样品进样1 uL,重复进样3次。
7.4 Q Exactive 质谱仪采集模式:
注意:以下列出的条件仅供参考,应根据所用质谱型号的不同加以调节。
Positive ion profile mode, NCE 30,Maximum ion injection time for survey scan 20ms,ions target values 3E6,Maximum ion injection time for MS/MS scan 60ms,ions target values 1E6,Dynamic exclusion 10s。
8.LFQ数据分析处理
可使用各种支持LFQ定量的质谱数据分析软件,可使用蛋白一级肽段母离子的MS信号强度定量,或者比较蛋白的MS2匹配数量定量。例如使用GE公司开发的DeCyder MSTM商业化软件,Trans-Proteomics Pipeline (TPP)以及Maxquant软件。
9.缩略语
2D:双向
LC:高效液相色谱
MS:质谱
ACN:乙腈
TFA:三氟乙酸
FA:甲酸
PBS:磷酸盐缓冲溶液
DTT:二硫苏糖醇
g:离心力
h:小时
mg:毫克
min:分钟
mL:毫升
NP:纳米颗粒
10.参考文献
[1]Saptarshi, S.R., A. Duschl, and A.L. Lopata, Interaction of nanoparticles with proteins: relation to bio-reactivity of the nanoparticle. J Nanobiotechnology, 2013. 11: p. 26.
[2]Xia, X.R., N.A. Monteiro-Riviere, and J.E. Riviere, An index for characterization of nanomaterials in biological systems. Nat Nanotechnol, 2010. 5(9): p. 671-5.
[3]Aggarwal, P., et al., Nanoparticle interaction with plasma proteins as it relates to particle biodistribution, biocompatibility and therapeutic efficacy. Adv Drug Deliv Rev, 2009. 61(6): p. 428-37.
[4]Tenzer, S., et al., Nanoparticle size is a critical physicochemical determinant of the human blood plasma corona: a comprehensive quantitative proteomic analysis. ACS Nano, 2011. 5(9): p. 7155-67.
[5]Arvizo, R.R., et al., Identifying new therapeutic targets via modulation of protein corona formation by engineered nanoparticles. PLoS One, 2012. 7(3): p. e33650.
[6]Shannahan, J.H., et al., Silver nanoparticle protein corona composition in cell culture media. PLoS One, 2013. 8(9): p. e74001.
国家纳米科学中心分析报告
