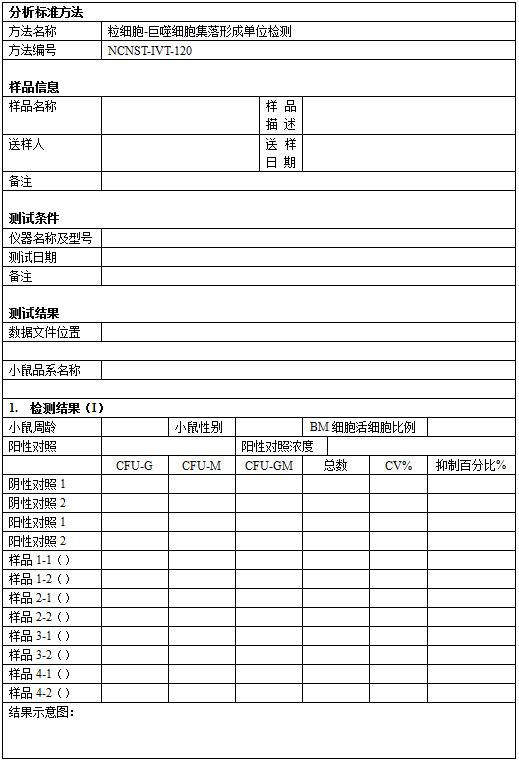
引 言
对于具有细胞毒性的抗肿瘤药物,骨髓抑制是一种常见的剂量限制性毒性。体内应用时,纳米粒子可能会在骨髓中分布,并/或将药物释放到骨髓中。因此检测纳米粒子或纳米粒子携带的药物的潜在毒性是临床前安全评估的非常重要的一个方面。
本文描述了一种使用小鼠骨髓(bone marrow, BM)定量检测粒细胞-巨噬细胞集落形成单位(granulocyte-macrophagecolony-forming units, CFU-GM)的方法。骨髓中的造血干细胞的增殖和分化会形成独立的细胞簇或集落。本方法可用于体外和离体检测。体外检测方法包括从健康动物中分离骨髓细胞,然后在体外用纳米粒子制剂进行处理。离体检测方法是指动物被注射纳米粒子制剂后分离骨髓。体外检测不能说明纳米粒子在体内的分布;但是,当处于纳米粒子制剂的早期研发阶段而不能确定剂量时,体外检测可以快速测定纳米粒子成分的潜在毒性。体外检测还可以快速评估结合于纳米粒子表面的具有细胞毒性抗肿瘤药物潜在的骨髓抑制毒性,并与与传统药物形式进行相比。
粒细胞-巨噬细胞集落形成单位检测
Mouse granulocyte-macrophage colony-forming unit assay
1.原理
本文详述的是体外CFU-GM检测方法。从8-12周龄的小鼠中分离出骨髓细胞,在以甲基纤维素为基础(MethoCult)的培养基中加入细胞因子(小鼠干细胞因子,mouse stem cell factor,mSCF;小鼠白介素3,mouse interleukin 3,mIL-3;人白介素6,human interleukin 6,hIL-6),用以培养经待测纳米粒子处理或未处理的骨髓细胞。MethoCult培养基中加入的细胞因子会促进CFU-GM的形成。骨髓细胞培养12天后,可以确定对照和样品的集落数量。采用StemCell技术有限公司的#28405技术手册中的方法进行骨髓分离及培养[1]。
2.仪器与试剂
以下列出的产品供应商仅以提供产品信息为目的,可以有同类产品的其他供货商所替代。
2.1 试剂
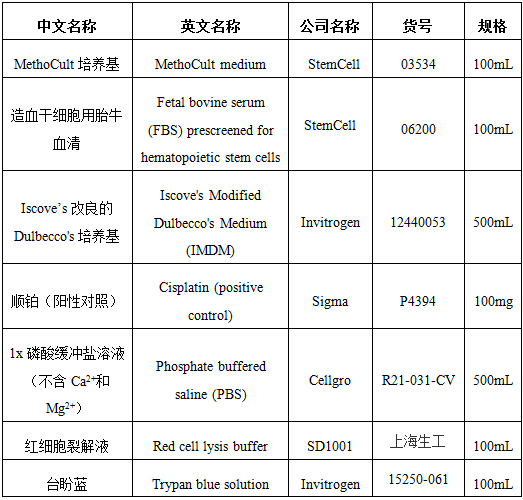
2.2 耗材
移液管(2mL,5mL,10mL)、培养皿(35mm、150mm)、注射器(5mL)、塑料烧杯、解剖剪、镊子、离心管(15mL)。
2.3 仪器
离心机、冰箱(4°C和-20°C)、细胞培养箱(37°C,5% CO2,95%湿度)、生物安全柜(可处理生物相关材料)、倒置光学显微镜、血细胞计数器(细胞计数仪)、涡旋混匀仪。
2.4 动物
本实验使用8-12周龄雄性或雌性C56BL6小鼠。建议至少使用两只小鼠的混合细胞进行实验。
或最高可行浓度。
本实验共检测纳米粒子的四个浓度:最高检测浓度及1:5连续稀释的三个不同浓度的样品。例如,最高检测浓度为1.0mg/mL,就需要浓度为22mg/mL的储液。三次1:5连续稀释该样品得到浓度为4.4、0.88和0.18mg/mL的样品。当0.15mL不同浓度的纳米粒子溶液分别于3.0mL细胞培养基(3.1)及0.15mL细胞上清(5.3)混合后,实验最终的检测浓度为1、0.2、0.04和0.008mg/mL。每个检测浓度需要3个0.15mL的平行测定(n=3)。
5.实验步骤
5.1 分离骨髓细胞:(1)背部朝下放置被处死的小鼠,用70%酒精清洗皮毛。(2)从胸廓下方剪开皮毛,不要剪到腹膜。紧抓住皮肤,经背部暴露后肢。(3)用无菌解剖剪从中间剪开膝关节。加下韧带和多余的组织。用镊子夹住股骨,从髋关节处剪下股骨。从踝关节处剪下胫骨。(4)用无菌解剖剪从中间剪开膝关节。加下韧带和多余的组织。用镊子夹住股骨,从髋关节处剪下股骨。从踝关节处剪下胫骨。(5)用5mL注射器和21或22号针头吸取1-3mL IMDM完全培养基。(6)将针头插入骨髓腔中,冲洗骨髓装入15mL管中。对所有骨头重复此步骤,骨髓冲洗液可以混合收集在一个离心管中。骨髓全部排出后骨头的颜色将变浅呈白色。(7)用移液管轻轻吹吸细胞3-4次,制备单细胞悬液,放置在冰上。(8)室温离心5min,1200rpm,去除上清。(9)根据细胞量,加入一定体积的红细胞裂解液(ACK),混匀后,室温离心5min,1200rpm,去除上清。(10)加入一定体积的IMDM完全培养基重悬细胞,用台盼蓝进行细胞计数。如果活细胞比例达到90%以上,可以继续后面的实验。
5.2 室温或冰箱中过夜解冻MethoCult培养基,并涡旋混匀。
5.3 用IMDM完全培养基将5.1.10计数后的细胞调整至密度为4×105个细胞/mL。
5.4 在3mL MethoCult培养基中加入150μL细胞悬液(5.3)和1xPBS(阴性对照)、顺铂(阳性对照)或待测纳米粒子溶液。每个浓度的待测样品包括三个平行测定(n=3)。涡旋混匀,并静置5min使气泡消散。
注意:在离体实验中,在3mL MethoCult培养基中加入IMDM完全培养基,并分别加入150μL不同动物的细胞悬液。无需额外加入1xPBS、纳米粒子溶液或顺铂阳性对照,因为动物已事先注射过各种制剂载体对照、纳米粒子和/或传统细胞毒性肿瘤药物制剂。
5.5 在每个35mm培养皿中分1.1mL上述细胞悬液,每个样品包括2个平行测定(n=2)(即为每个待测样品准备6个35mm培养皿)。
5.6 将两个装有细胞的有盖35mm培养基和一个装有3mL无菌水的无盖培养皿一起装入一个150mm有盖培养皿中。
5.7 将150mm有盖培养皿放入37°C,5%CO2,湿度95%的培养箱中。
5.8 培养12天后,按下述方法确认并计数细胞集落。8-12周龄C57BL6小鼠CFU-GM检测的典型值为64±16。
5.9 确认CFU-GM:CFU-GM包括三类:CFU-粒细胞(CFU-G)、CFU-巨噬细胞(CFU-M)和CFU-粒-巨噬细胞(CFU-GM)。集落数量从30个至上千个不等,三种类型均可能出现。CFU-GM集落通常包括多簇,看上去像一个被细胞包围的紧密的核。单核细胞通常是比较大的细胞,呈现椭圆形或圆形,并似乎含有一个颜色比较暗淡的中心。粒细胞通常是较圆的、明亮的细胞,比巨噬细胞更小,且尺寸更均一。在CFU-GM集落中很容易看到独立的细胞,尤其是在边缘。详见图1中对CFU-GM、CFU-M和CFU-G集落的描述。
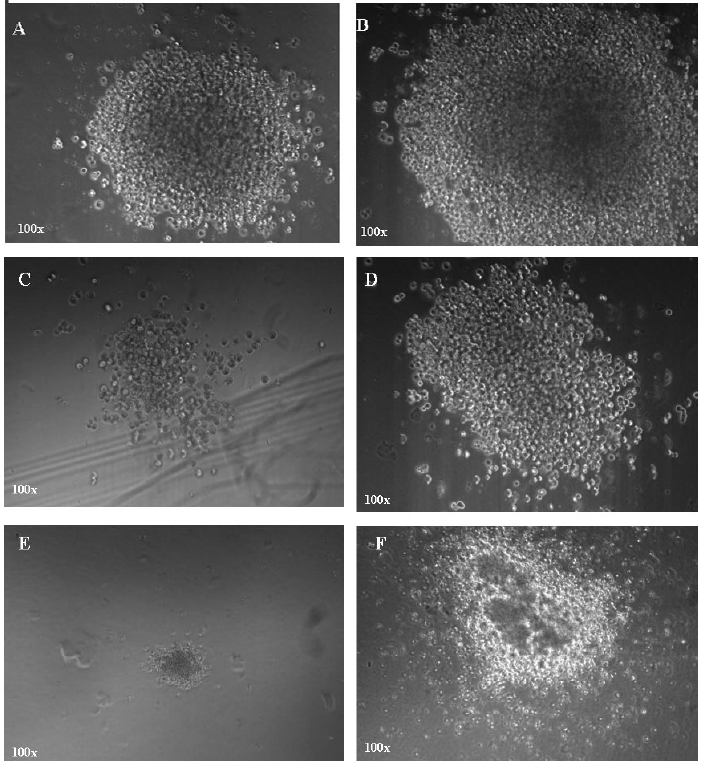
图:CFU-GM、CFU-M和CFU-G集落。其中A、B是CFU-GM集落。C、D是CFU-M集落。E是一个单独的CFU-G集落。F是一些CFU-G集落生长在一起的情况。
6.数据分析
6.1 变化系数百分比(percent coefficient of variation,CV%):其中SD为标准偏差。
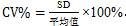
6.2 CFU抑制百分比

7.接受标准
7.1 每个对照及待测样品的CV%都应小于30%。
7.2 如果阳性对照或阴性对照不能达到7.1的标准,实验需要重新进行。
7.3 如果同一个对照或样品的恋歌平行测定结果相差大于25%,该样品需要重新进行分析。
8.缩略语
API:活性药物成分
BM:骨髓
CFU:集落形成单位
CFU-G:粒细胞集落形成单位
CFU-GM:粒细胞-巨噬细胞集落形成单位
CFU-M:巨噬细胞集落形成单位
CV:变化系数
FBS:胎牛血清
hIL-6:人白介素-6
IMDM:Iscove’s改良的Dulbecco’s培养基
mIL-3:小鼠白介素-3
min:分钟
mSCF:小鼠干细胞因子
PBS:磷酸缓冲盐溶液
SD:标准偏差
9.参考文献
[1] Mouse Colony-Forming cell Assays Using MethoCult. Technical manual. StemCell Technologies Inc., cat # 28405.
[2] Dominique Pifat. Assay Validation.
http://www.fda.gov/cber/summaries/120600bio10.ppt - 05-24-2003.
[3] Dobrovolskaia MA, Potter TM. Mouse granulocyte-macrophage colony-forming unit assay. NCL Method (2009) ITA-3 (Version 1.1):1-13.
国家纳米科学中心分析报告