引 言
本文描述的方法是利用氧化还原活性的荧光探针,检测纳米粒子对于肝癌细胞(Hep G2)活性氧(reactive oxygen species, ROS)形成的影响。
肝癌细胞活性氧检测
ROS assay for hepatoma cells
1.原理[1,2]
二氯荧光黄双乙酸盐(Dichlorofluoresceindiacetate, DCFH-DA)是一种ROS探针,它在细胞内会经历脱乙酰作用,之后由ROS介导的氧化生成荧光物(激发波长λex=485nm,发射波长λem=530nm)。DCFH-DA可被用来测量细胞质和细胞器(如线粒体)中ROS的生成。可用微板分光光度计定量检测荧光强度。
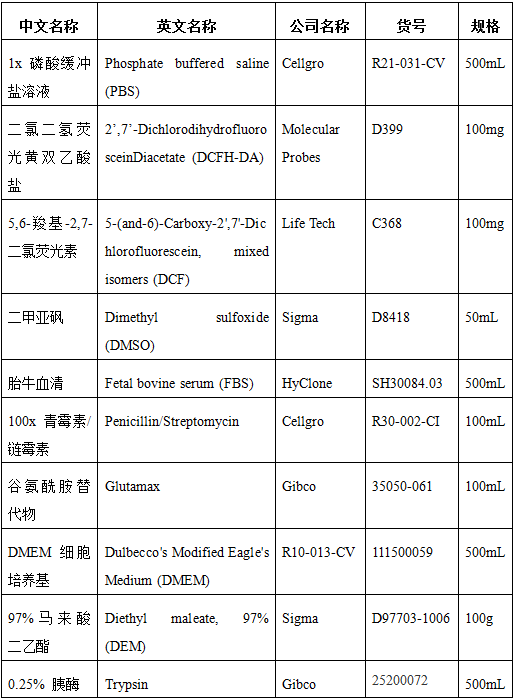
2.仪器与试剂
以下列出的产品供应商仅以提供产品信息为目的,可以由同类产品的其他供货商所替代。
2.2 耗材
移液管(2mL,5mL,10mL)、96孔平底细胞培养板、离心管(15mL)、黑色Costar 96孔板。
2.3 仪器
离心机、冰箱(4℃和-20℃)、细胞培养箱(37℃,5% CO2,95%湿度)、生物安全柜(可处理生物相关材料)、倒置光学显微镜、血细胞计数器(细胞计数仪)、涡旋混匀仪、酶标仪。
2.4 细胞系
Hep G2(人肝癌细胞系)
3.试剂配制
3.1 DMEM完全培养基(无菌):10% FBS(经过热灭活)、2mM Glutamax、100U/mL 青霉素、100μg/mL链霉素。避光保存在2-8℃,不超过一个月。使用前,要37℃水浴中预热。
3.2 DEM,阳性对照(positive control, PC):用DMEM完全培养基(3.1中所述)制备5mM DEM 溶液。
3.3 阴性对照(negative control, NC):DMEM完全培养基。
3.4 ROS荧光探针试剂:(在暗室中制备,溶液需避光!)(1)DCFH-DA储液(10mM):5mg溶解于1mL DMSO。(2)DCFH-DA工作液(40μM):50mL 1xPBS中加入200μL 10mM储液。
3.5 DCF: (在暗室中制备,溶液需避光!)(1)DCF储液(225mM)100mg溶解于1mL DMSO。(2)DCF工作液(40μM):50mL 1xPBS中加入8.9μL 225mM储液。
3.6 热灭活FBS:在2-8℃解冻一瓶FBS,热灭活前恢复至室温。放入56℃水浴中30min,并且每隔5min混匀一次。根据每次实验的用量(~50mL),分装后保存在-20℃。每次使用前,在2-8℃解冻。剩余FBS可在2-8℃保存一个月。
4.样品制备:纳米粒子样品溶液的配制
4.1 如果被检测的纳米粒子的最高工作浓度为1mg/mL,那么需要按照1:5的稀释比例,使用维持培养基依次稀释至0.2mg/mL、0.04mg/mL和0.008g/mL。每一个浓度的纳米粒子应该设置4个平行测定。
4.2 选择合适的纳米粒子溶液的浓度时,必须考虑以下几个问题:(1)纳米粒子在某种生物相容性缓冲液中的溶解度(2)用NaOH或HCl调节纳米粒子至生理pH值(6-8)。(3)纳米粒子的可用性及稳定性。
如果1mg/mL的最高工作浓度不适合,需要对此浓度进行调整,一定要在适合的浓度下分析样品。
5.实验步骤
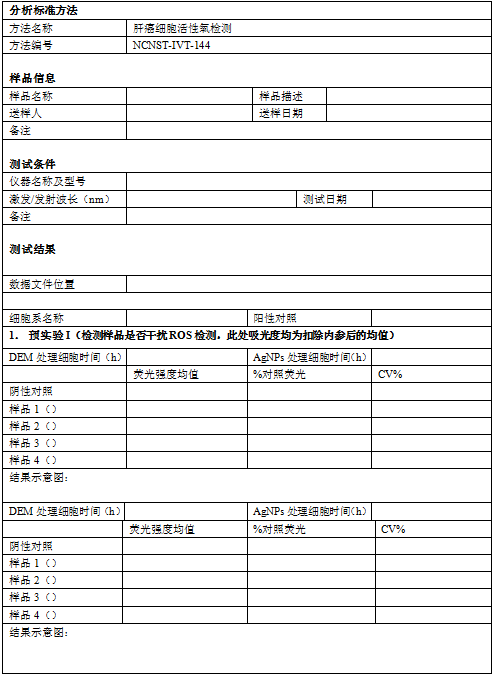
5.1 预实验Ⅰ(检测样品是否干扰ROS检测)
5.1.1 细胞培养两天后,使用台盼蓝和血细胞计数器计数活细胞。用DMEM 完全培养基将细胞稀释到4x105cell/mL。
5.1.2 在黑色96孔板中,按照表1,每孔加入100μL细胞悬液,在37℃、5%CO2和95%湿度的培养箱中孵育24h。
5.1.3 按照表1,在每个样品中加入100μL 40μM DCFH-DA(终浓度为20μM),对照组为1x DPBS,在37℃、5%CO2和95%湿度的培养箱中孵育30min。
5.1.4 70xg离心培养板4min。去除上清,用200μL 1xPBS洗细胞。70xg离心培养板4min(不包括降速时间)。
5.1.5 去除上清后,按照表1,每孔加入200mL 5mM DEM 孵育细胞1h。
5.1.6 去除上清后,在相应的孔加入200μL不同浓度的纳米粒子溶液,读取相应的荧光值(λex=485nm,发射波长λem=530nm)。
表1 预实验Ⅰ每个实验组的加样设计方案
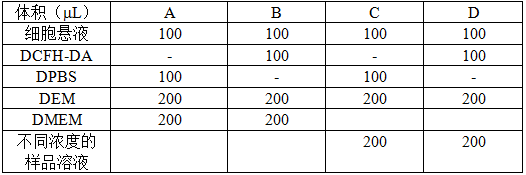
5.1.7 比较B-A与D-C两个差值,根据T-test结果,判断样品本身是否会影响ROS检测,在后续正式实验中,避免使用有影响的样品浓度。
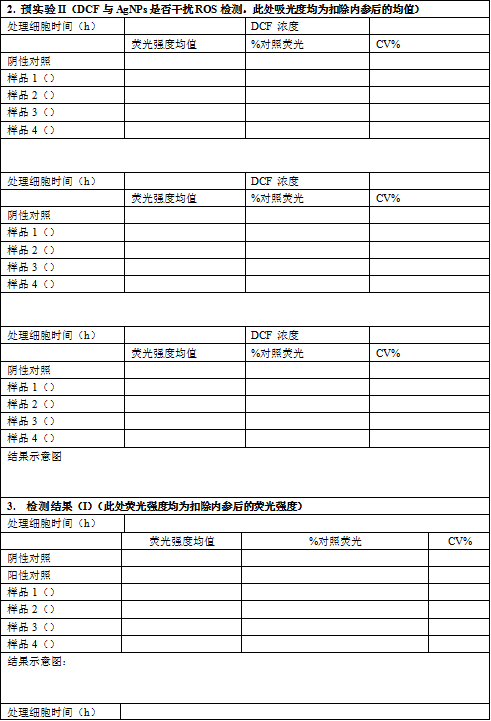
5.2 预实验Ⅱ(检测DCF与AgNPs是否干扰ROS检测)
5.2.1 在96荧光板中每孔加入100μL 40μM DCF,对照组为1xDPBS。
5.2.2 按照表2,在相应的孔中加入100μL不同浓度的纳米粒子溶液,(避光!)分别孵育0、3和12h后将对应的培养板从培养箱中取出,读取相应的荧光值(激发波长λex=485nm,发射波长λem=530nm)。
表2 预实验Ⅱ每个实验组的加样设计方案
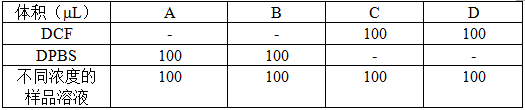
5.2.3 B-A与D-C两个差值,根据T-test结果,判断DCF与AgNPs是否干扰ROS检测。
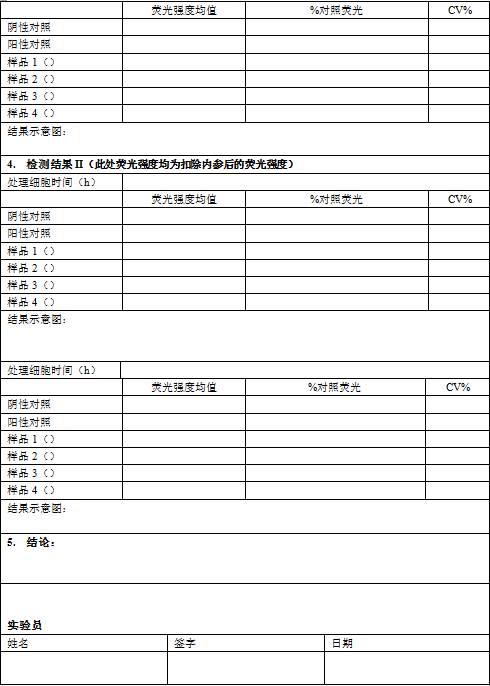
5.3 ROS实验检测
5.3.1 细胞培养两天后,使用台盼蓝和血细胞计数器计数活细胞。用DMEM完全培养基将细胞稀释到4×105个/mL。
5.3.2 按照图1,除空白孔外(培养基对照),每孔加100μL细胞。无细胞对照组均设2个平行测定,阳性对照、阴性对照和待测样品均设4个平行测定。根据纳米粒子不同的作用时间,共设置3个96孔板,分别对应2、4和6h。
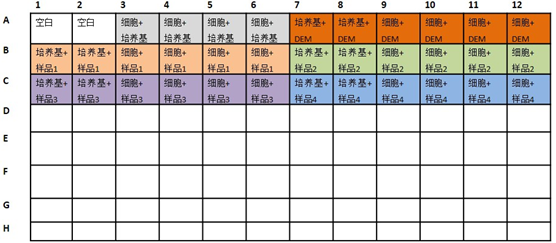
图1 加样图例。其中“细胞+培养基”为NC,“培养基+DEM”为PC
5.3.3 在37℃、5%CO2和95%湿度的培养箱中孵育24h。
5.3.4 (避光操作!)在每个样品中加入100μL 40μM DCFH-DA(终浓度为20μM),在37℃、5%CO2和95%湿度的培养箱中孵育30min。
5.3.5 70xg离心培养板4min。去除上清,用200μL 1xPBS洗细胞。70xg离心培养板4min(不包括降速时间)。
5.3.6 去除上清后,之后按图1在每板中加入200μL不同浓度的纳米粒子溶液。
5.3.7 避光!)分别孵育0、3和12h后将对应的培养板从培养箱中取出,读取相应的荧光值(λex=485nm,λem=530nm)。
6.数据分析
6.1 变化系数百分比:CV% = SD/mean x 100,其中SD为标准偏差,mean为平均值。
6.2 阴性对照、阳性对照和待测样品的荧光值,应该是各自孔的测量值减去相应的无细胞对照组测量值的平均值。
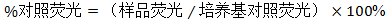
7.接受标准
7.1 阳性对照DEM 2h的荧光测量值应至少为培养基对照的140%。
7.2 阳性对照和样品的平行测定的CV%应小于50%。
7.3 达到7.1和7.2标准的检测结果可以被接受。否则,应重复实验直到达到接受标准。
8.缩略语
CV:变化系数
DCFH-DA:二氯荧光黄双乙酸盐
DEM:马来酸二乙酯
DMSO:二甲亚砜
FBS:胎牛血清
PBS:磷酸盐缓冲液
ROS:活性氧
9.参考文献
[1] Black MJ.Brandt RB.Spectroflurometric analysis of hydrogen peroxide. Anal Biochem(1974)58:246.
[2] Stem ST, Zolnik BS. Hepatocyte primary ROS assay. NCL Method(2010)GTA-3(Version 1.0):1-9.
国家纳米科学中心分析报告