



纳米材料进入机体后,不可避免会吸附体液中的蛋白质分子,形成纳米材料-蛋白质冠 (nanoparticle-protein corona),对纳米材料生物学效应及其生物医学应用产生重大影响。因此,研究纳米材料与蛋白质作用的界面结构有着重要意义。
目前,如何解析纳米材料与蛋白质作用的界面结构仍然面临着诸多挑战。虽然圆二色谱、核磁共振、X射线晶体衍射等方法均为蛋白质结构研究的重要手段,但在界面结构解析上存在诸多局限。
为了解决该难题,国家纳米科学中心陈春英课题组与吴晓春课题组及中科院高能物理所李敬源课题组合作,应用多种同步辐射技术研究了纳米材料-蛋白质作用。应用X射线吸收近边结构研究了模型蛋白质牛血清白蛋白 (BSA)与金纳米棒的结合方式,通过解析结合前后硫元素的化学形态并结合分子动力学理论模拟,首次揭示了BSA分子中至少有6对二硫键被打开,形成了 BSA与金表面识别与结合的特定界面 (plane S),通过Au-S键构成了牢固吸附的蛋白质冠。应用同步辐射微束x射线荧光光谱研究了金纳米棒-BSA复合体在细胞内的转运和降解过程,发现牢固吸附的蛋白质冠对金纳米棒表面的CTAB双层结构形成物理屏蔽,显著降低了其损伤细胞膜所造成的急性毒性和坏死;在细胞内蛋白质冠降解,CTAB双层重新暴露增加了溶酶体膜的通透性,最终诱导细胞凋亡。该研究将同步辐射分析方法和理论模拟有机结合,为研究纳米材料-蛋白质界面作用及生物学效应提供了重要的方法学,发表于近期《美国化学会会志》 (J. Am. Chem. Soc. 2013, 135, 17359-17368.)。
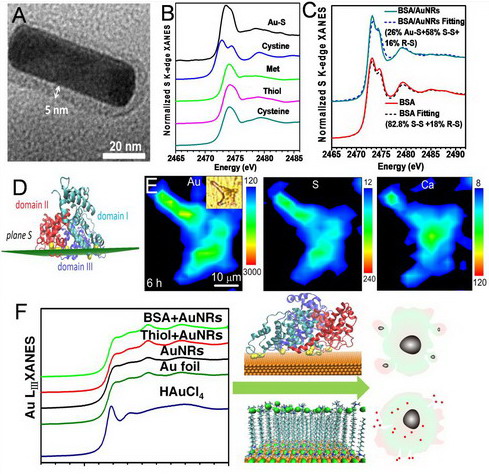
图1. 结合同步辐射分析技术和分子动力学模拟解析纳米材料形成蛋白质冠的界面结构。
此外,我们还研究了纳米材料表面化学如何影响纳米材料-细胞膜界面作用及其效应。传统观念认为,纳米材料表面的正电荷导致细胞膜损伤和细胞毒性,该研究对此提出了质疑,发现在纳米材料吸附于细胞膜并破坏膜结构的过程中,纳米材料表面的分子类型及排列结构而非表面电荷起主要作用(Nanoscale 2013, 5, 8384),提示了纳米材料-生物膜界面相互作用的多样性和复杂性。
近年来,陈春英课题组利用同步辐射与核分析技术针对多种典型纳米材料开展了系统的研究,建立了研究纳米材料生物效应的多学科集成方法学。在微观水平上,研究了纳米材料-生物分子、生物膜界面的作用;在宏观水平上,研究了纳米材料在生物体内的转运、蓄积、化学形态转变及其生理病理学效应 (Anal. Bioanal. Chem. 2010, 396, 1105; Nano Lett. 2011, 11, 772; Nano Lett. 2011, 11, 3174; PNAS 2011, 108, 16968; PNAS 2012, 109:15431; Adv. Mater. 2013, 25, 5928; Adv. Mater. 2013, 25, 3869; Acc. Chem. Res., 2013, 46, 702)。2010年,课题组应邀英国皇家化学会RSC Publishing主编了图书专著“Nuclear Analytical Techniques for Metallomics and Metalloproteomics”,系统介绍了先进核分析技术及其应用,并积极推进这些方法在纳米生物学领域的应用,得到国际同行的密切关注和好评,也再次受英国皇家化学会邀请撰写了综述文章“先进核分析技术在纳米毒理学中的应用”(Chem. Soc. Rev. 2013, 42, 8266-8303),系统地总结了先进核分析技术在纳米材料表征、纳米-生物界面结构分析、纳米材料在细胞内的可视化研究、纳米材料在生物体内的分布、蓄积与转化等方面的应用。
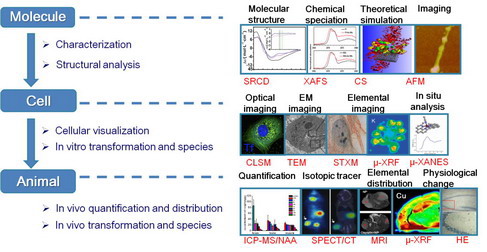
图 2 利用先进核分析及多学科集成技术解决纳米生物效应研究中的的瓶颈问题
本研究是在大科学装置(北京同步辐射装置、上海光源)和日本筑波KEK光子工厂的大力支持下完成的,并得到了中国科学院、国家科技部、国家自然科学基金、欧盟第七框架计划的资助。