



近年来,随着基因操控技术的不断成熟,个体化的基因治疗逐渐发展起来。各类基因治疗药物,如反义核酸,小干扰RNA,功能基因,以及基因编辑系统等,逐渐发展成为继传统小分子药物和抗体蛋白类药物之后的第三代治疗药物。安全可靠且高效的基因治疗类药物载体的研发越来越引起广泛关注,具有重大的研究价值和广阔的应用前景。基于碱基互补配对的核酸自组装结构,可被设计成具有特定尺寸和形貌的纳米结构,其在装载、传递及响应性释放与其化学组成一致的核酸类药物方面具有显著优势。
国家纳米科学中心丁宝全课题组在利用多功能核酸纳米结构递送基因治疗药物领域已获得一系列进展(Angew. Chem. Int. Ed. 2018, 57, 15486; Nano Lett. 2018, 18, 3328; ACS Appl. Mater. Interfaces 2018, 10, 23693)。该类基于多功能核酸纳米结构的核酸给药体系表现出非常好的靶向性和生物相容性,可作为全新的基因治疗类药物载体。在最近发表的研究工作中,丁宝全研究组首次利用基于环形超分子为内核的支链DNA结构高效共组装基因编辑系统和反义核酸,共组装体系能够对细胞内环境响应,高效释放基因治疗组分,实现对肿瘤细胞内靶标基因的有效编辑和沉默。该研究成果以题为“A Self-Assembled Platform Based on Branched DNA for sgRNA/Cas9/Antisense Delivery”被J. Am. Chem. Soc. 杂志在线发表(2019, DOI: 10.1021/jacs.9b09043)。
基因治疗在肿瘤治疗领域的研究已经被广泛报道,主要是通过各类阳离子脂质体,高分子聚合物和无机纳米颗粒等为载体递送基因治疗药物,从而上调抑癌基因或编辑以及沉默癌基因,达到抑制肿瘤的目的。核酸自组装结构作为一种生物相容的纳米载体具有很好的装载和传递核酸类药物的能力。在这项研究中,丁宝全课题组利用环形超分子β环糊精为内核共价偶联核酸序列,制备核酸支链结构。同时,他们首次对基因编辑系统中的sgRNA(靶向肿瘤相关基因PLK1)的3’端进行延伸,构建一段能够同反义核酸进行碱基互补配对的RNA链(sgRNAL)。然后,引入一条两端被二硫键修饰的反义核酸序列AS(靶向肿瘤相关基因PLK1)作为连接子序列,实现基因编辑组分(sgRNA/Cas9)和基因沉默组分(AS)之间的共组装,构建以核酸为载体的基因治疗纳米复合物。在超分子主客体识别机制下,通过引入金刚烷修饰的核酸适配体和内涵体逃逸肽,赋予该纳米给药体系的细胞靶向性和内涵体逃逸能力。随后,在细胞内还原性谷胱甘肽和RNase H酶的作用下,实现响应性逐级释放基因编辑组分(sgRNA/Cas9)和基因沉默组分(AS),实现协同的基因治疗目的,达到对肿瘤细胞的杀伤。小鼠活体实验结果表明,该类DNA纳米给药体系表现出非常好的肿瘤靶向性和生物相容性,能够对肿瘤模型产生显著的基因治疗效果。该研究基于核酸自组装和超分子主客体识别机制,充分利用组装结构对生物环境内标志分子的响应性,实现了基因编辑系统和基因沉默系统的协同给药,为恶性肿瘤等疾病的治疗提供新的研究策略。
论文的第一作者是国家纳米中心刘建兵助理研究员,通讯作者为丁宝全研究员。该研究得到了国家自然基金委和中科院前沿科学重点研究计划等项目的支持。
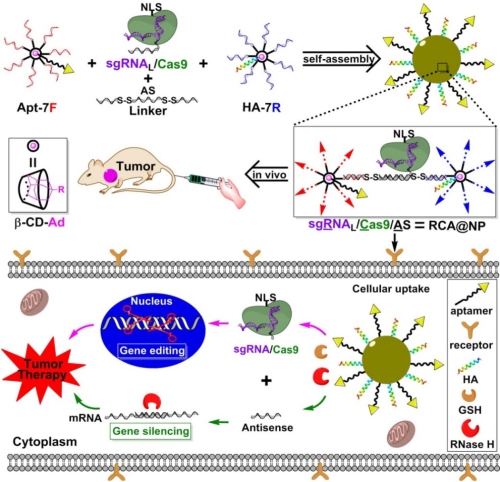
图:响应性核酸自组装结构装载基因编辑系统和反义核酸,靶向肿瘤实现肿瘤生长抑制