



近日,国家纳米科学中心丁宝全研究员课题组在DNA纳米机器用于精准化智能化肿瘤疫苗研究方向取得重要进展。研究成果“A DNA nanodevice-based vaccine for cancer immunotherapy”发表于Nature Materials(DOI:10.1038/s41563-020-0793-6; https://rdcu.be/b6SOx)。
恶性肿瘤是一类严重危害人类健康的重大疾病。肿瘤免疫治疗能够调控自身的免疫系统,有效地清除恶性肿瘤细胞。多种肿瘤免疫治疗策略为肿瘤治疗带来了新的希望。其中肿瘤疫苗研究被广泛关注,尤其是针对特定患者的个体化疫苗越来越受到研究者的重视。然而,疫苗在前期研究和临床试验中的抗肿瘤治疗效果仍然不理想。其中一个主要的原因是缺少理想的运输载体,将佐剂分子和抗原分子高效共递送到淋巴器官,从而实现高效的免疫系统激活。此外,免疫功能成分精准定量及在其作用位点的可控释放也是极大的挑战。
基于分子自组装的DNA纳米结构具有结构精确可控、易于化学修饰、生物可降解等特点,是一种很有潜力的纳米载体,在药物靶向运输、可控释放、多种药物协同运输治疗等方面已展示了非常广阔的应用前景。丁宝全课题组在前期的工作中根据生理病理的标志物分子设计构筑了刺激响应型DNA自组装结构及DNA纳米机器,实现了功能蛋白、核酸药物、小分子化药等组分的精准靶向递送及可控释放,在动物水平的多种肿瘤模型展现了良好的治疗效果(Nature Biotechnol., 2018, 3, 258; Angew. Chem. Int. Ed., 2018, 57, 15486; J. Am. Chem. Soc., 2019, 141, 19032)。这些研究提出了药物递送体系程序化设计的研究思路,为肿瘤等疾病的治疗提供了全新的精准化智能化策略。
在前期研究的基础上,丁宝全课题组提出了利用DNA纳米机器构建抗肿瘤疫苗的概念。他们利用DNA折纸技术,构建尺寸形状精准可控、同时搭载肿瘤抗原和多种佐剂的肿瘤疫苗体系,利用抗原特异性的免疫反应进行肿瘤免疫治疗。首先选用肿瘤抗原多肽与单链DNA进行共价偶联,同时针对位于免疫细胞内涵体内的免疫通路受体TLR3及TLR9选取核酸免疫佐剂dsRNA 与CpG,通过核酸分子的杂交在纳米机器内部进行定位定量的装载。设计酸响应的DNA分子锁将装载了各种功能成分的DNA结构封闭,形成完整闭合的DNA纳米机器,保护内部的免疫功能组分。DNA纳米机器由于特殊设计的尺寸形状能够被高效富集到淋巴结,当进入淋巴结内树突细胞后,在内涵体微酸性环境中,分子锁响应性开启,DNA纳米机器由关闭状态转变为开启状态,共同释放抗原和多种佐剂,刺激树突细胞活化和抗原递呈,诱发抗原特异性免疫反应,有效杀伤肿瘤细胞。搭载不同肿瘤抗原多肽的DNA纳米机器在黑色素瘤、结直肠肿瘤小鼠模型上都展现良好的抗肿瘤疗效。由于解决了肿瘤疫苗精准化及多佐剂联用的难题,纳米机器显示了长期的免疫记忆效果,有效抑制肿瘤复发与转移。这种基于多种成分共同精准组装、刺激响应控制的DNA纳米机器在肿瘤疫苗体系的开发及个体化的肿瘤免疫治疗应用中显示了巨大潜力。同时,DNA纳米机器具有可程序化设计的特点,可以通过进一步设计优化用于病毒相关抗原及佐剂等功能成分的递送,有望为抗病毒疫苗的构建提供全新的平台。
国家纳米科学中心博士生刘少利和蒋乔研究员为该论文的共同第一作者,丁宝全研究员为通讯作者。该研究得到北京市科技计划(前沿新材料研究)、国家自然科学基金、中科院战略性先导科技专项及前沿科学重点研究计划、科技部重点研发计划等项目的支持。
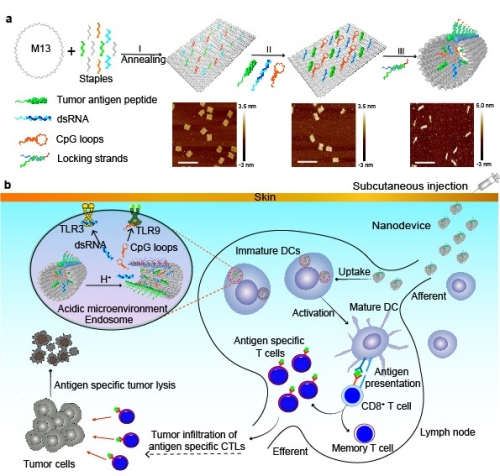
(a)DNA折纸构建肿瘤抗原肽/ CpG环/ dsRNA共同负载的纳米机器肿瘤疫苗示意图
(b)利用DNA纳米机器进行癌症免疫治疗的示意图