



急慢性肾损伤患者进行血液透析时的一大问题是透析环路中产生的凝血反应。肝素与低分子量肝素常用于临床血液透析过程中,但仍具有诸多不良反应;而其解毒剂鱼精蛋白则具有一定毒性。开发高效、可控、安全的抗凝剂用于透析仍是临床实践的重大需求。相较于直接清除循环系统中的抗凝药物,利用解毒剂对其活性进行控制则是一种更安全的调控方法。利用指数富集的配体系统进化(SELEX)技术筛选得到的核酸适配体既能够有效抑制凝血酶活性,又可利用互补序列与适配体杂交形成双链,通过破坏适配体与凝血酶结合域实现快速解毒,从而减少或避免出血风险。但核酸适配体在实际使用中仍然受到诸多限制,如核酸序列在体液内稳定性较差、易被降解、易被代谢清除,限制其进一步应用。为了提升核酸适配体在活体内的稳定性,实现长循环,目前已有报道利用纳米颗粒结合核酸适配体实现其“纳米化”,则可以在不影响其活性的基础上提高稳定性,这一策略已被用于靶标配体的筛选或检测探针研究,但目前这种功能化纳米结构用于医学实践的报道还比较少。
在纳米医学领域中,DNA纳米技术展现了巨大的潜能。其中DNA折纸技术(DNA origami)作为一种独特的DNA自组装策略获得了研究者的广泛关注。DNA纳米材料具有结构精确可控、易于化学修饰、生物可降解等特点,在药物靶向运输、可控释放、多种药物协同运输治疗、智能药物体系构建等方面有非常广阔的应用前景。丁宝全课题组在这一方向上已经取得了一系列进展(Nature Biotechnol., 2018, 3, 258; Nature Mater., 2020, DOI: 10.1038/s41563-020-0793-6, Angew. Chem. Int. Ed., 2020, DOI: 10.1002/anie.202009842)。
在前期研究的基础上,丁宝全课题组设计制备了一种DNA折纸纳米结构,通过引导控制抗凝核酸适配体的排布,构建得到一种稳定、高效、安全、可快速解毒的纳米抗凝剂(图1)。该研究成果以“A DNA origami-based aptamer nanoarray for potent and reversible anticoagulation in hemodialysis”发表于Nature Communications(2021, 12, 358, DOI:10.1038/s41467-020-20638-7)。
研究人员利用DNA折纸技术获得长方形纳米结构,该纳米结构表面所有位点和序列均经过预先设计。通过位点控制,能将凝血酶核酸适配体杂交组装到纳米结构表面形成阵列,适配体的种类、位点分布和密度均可调整。这种纳米抗凝剂能有效识别结合凝血酶,稳定抑制凝血酶的活性而产生抗凝血的效果。同时,可以通过适配体互补链的加入,抑制适配体与凝血酶的结合,快速解毒而恢复凝血酶功能。由于是纳米级抗凝剂,其尺寸和分子量相较于核酸适配体本身都有明显增加,在活体具有更长的存留时间。研究表明,在凝血酶/纤维蛋白原混合溶液、小鼠血浆、人血浆/全血、小鼠活体中,这种DNA纳米抗凝剂均显示了其良好的抗凝性能与快速解毒的效果。丁宝全课题组与积水潭医院的专家合作,将DNA纳米抗凝剂用于体外透析环路模型中。纳米抗凝剂也展现出了良好的抗凝特性,有效的抑制了环路中血凝块的形成。这种由生物大分子构成、具有良好生物相容性的DNA纳米结构为构建安全、可程序化设计的纳米抗凝剂提供了新的研究策略。
国家纳米科学中心博士研究生赵帅、硕士研究生田润和北京积水潭医院检验科吴俊主任为该论文共同第一作者,蒋乔研究员和丁宝全研究员为共同通讯作者。该研究得到北京市科技计划(前沿新材料研究)、国家自然科学基金、中科院战略性先导科技专项 (B类) 等项目的支持。
原文链接:https://www.nature.com/articles/s41467-020-20638-7 。
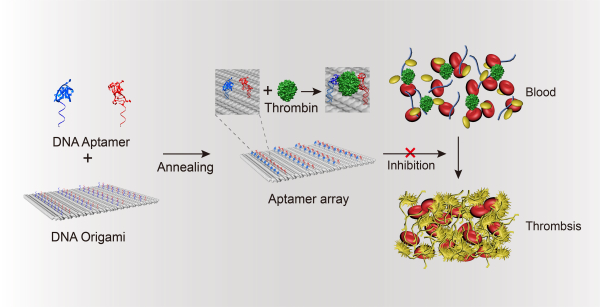
图1 基于DNA折纸结构的纳米抗凝剂的构建