



肿瘤疫苗是指利用肿瘤抗原,通过主动免疫方式诱导机体产生特异性抗肿瘤效应,激发机体自身的免疫保护机制,达到治疗肿瘤或预防肿瘤发生的作用。尽管基于疫苗的抗肿瘤疗法有优越的理论基础,但目前仍不能达到令人满意的临床治疗效果。其中,提高疫苗的免疫刺激效率是肿瘤免疫治疗领域的重要研究方向之一。
为了解决这一难题,国家纳米科学中心王海研究团队构建了一种高效、可直接呈递主要组织相容性复合体(MHC)-肿瘤抗原给T细胞的纳米树突状细胞(DC)疫苗。通过体外控制刺激条件的方式,将小鼠体内提取并诱导出的骨髓来源树突状细胞(BMDCs)和肿瘤细胞-细菌融合材料共孵育,以此得到包含MHC-肿瘤抗原复合物的个性化DC疫苗。将提取包含有个性化MHC-肿瘤抗原复合体和共刺激因子(CD80/86)的细胞膜包覆在叶酸-铁离子自组装的树突状纳米颗粒上,以此构建得到可直接刺激T细胞诱导特异性肿瘤免疫反应的纳米DC疫苗。实验结果表明,该纳米DC呈现显著淋巴结归巢能力和诱导特异性细胞免疫效果,在体内有效抑制了肿瘤生长和转移灶形成,且诱导了记忆T细胞的长期免疫保护,有望用于个性化肿瘤免疫治疗。相关研究成果以Direct Presentation of Tumor-Associated Antigens to Induce Adaptive Immunity by Personalized Dendritic Cell-Mimicking Nanovaccines为题,发表于Advanced Materials(2022, DOI: https://doi.org/10.1002/adma.202205950)。
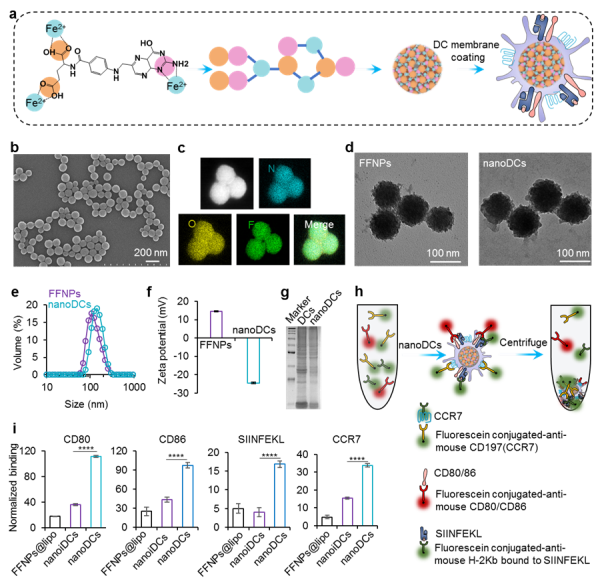
图 1. a) 合成纳米DC疫苗示意图;b-d)SEM和TEM表征树枝状纳米颗粒;e-f) 纳米颗粒粒径分布和电荷表征;g-i) 蛋白质电荷和pull-down试验验证纳米DC疫苗携带相关疫苗递呈蛋白复合体
mRNA技术可以通过人体细胞的蛋白质合成系统合成出特异性的肿瘤抗原,以诱导免疫反应从而特异性的攻击肿瘤细胞,因此,mRNA肿瘤疫苗成为个性化免疫治疗的另外一种重要策略。脂质纳米颗粒(LNPs)作为非病毒递送载体将mRNA递送至胞质,然而目前mRNA-LNPs疫苗的超低温储存和运输极大地阻碍了其临床应用。为了提高mRNA- LNPs疫苗的热稳定性和对免疫系统刺激的持久性,研究团队采用一种可变形的水凝胶-LNPs系统(HA-mRLNPs),可在室温下存储mRNA疫苗,用于体内持久免疫治疗。首先,通过构建高混合效率的微流控芯片实现封装编码肿瘤抗原mRNA和免疫佐剂的新型LNPs,随后通过动态透明质酸水凝胶限制LNPs的迁移和融合以提高mRNA疫苗在室温下的储存时间。此外,透明质酸链在生理条件下是可移动的,不能永久保持凝胶状状态,从而可控的释放mRNA纳米疫苗,并递送至树突状细胞,进而诱导抗原特异性T细胞杀伤肿瘤细胞。纳米疫苗在室温保存至少14天后,其功能仍保持不变。本研究证明稳定和持久免疫水凝胶-LNPs体系可以用于有效的肿瘤免疫治疗。相关研究成果以Stabilizing RNA Nanovaccines with Transformable Hyaluronan Dynamic Hydrogel for Durable Cancer Immunotherapy为题,发表于Advanced Functional Materials(2022, DOI: 10.1002/adfm.202204636)。
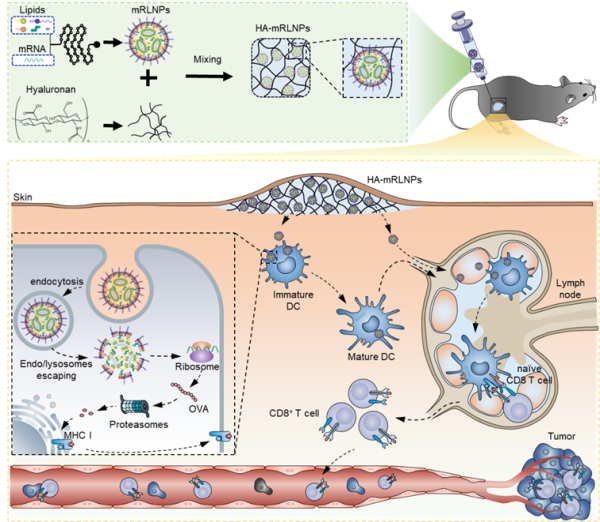
图 2. 水凝胶-LNPs系统制备和体内肿瘤免疫示意图
国家纳米科学中心博士生张杰和硕士生贾福浩分别为Advanced Materials和Advanced Functional Materials的第一作者。王海研究员为文章的通讯作者。国家纳米科学中心聂广军研究员对该研究工作给予大力支持,上述研究工作得到了中科院战略性先导科技专项、国家自然科学基金和国家纳米科学中心启动基金的支持。
相关链接:
论文1:https://onlinelibrary.wiley.com/doi/10.1002/adma.202205950