



近日,国家纳米科学中心杨延莲研究员、朱凌项目研究员与中国医学科学院基础医学研究所余佳研究员合作,在基于工程化细胞外囊泡药物递送体系的肿瘤N6-甲基腺嘌呤核苷酸甲基化(m6A)表观遗传调控与免疫疗法方面取得新进展。相关研究成果以m6A Reader YTHDF1-targeting Engineered Small Extracellular Vesicles for Gastric Cancer Therapy Via Epigenetic and Immune Regulation为题,在线发表于《先进材料》(Advanced Materials, 2022, DOI:10.1002/adma.202204910)。
m6A是一种存在于真核生物中最普遍的RNA转录后修饰,参与DNA修复、细胞分化及细胞周期凋亡等基本生命活动,在肿瘤起因和发展中起着重要作用。RNA甲基化含量和甲基化RNA的稳定性、代谢、表达和生物功能由甲基转移酶、脱甲基酶和m6A阅读蛋白动态调节。研究表明,m6A 甲基化阅读蛋白YTH N6甲基腺苷RNA结合蛋白1(YTHDF1)在胃癌组织中过表达,且与胃癌的发生、进展和远端转移相关。因此,靶向YTHDF1并进行m6A的表观遗传调控有望实现对胃癌的抑制和治疗。靶向YTHDF1进行RNA干扰是有效的策略,但是尽管胃癌组织YTHDF1高表达,正常组织中YTHDF1也广泛分布,所以存在m6A表观遗传调控的特异性差、具有系统毒性和免疫原性等问题,限制了其临床应用。而且核酸药物的递送效率也是急需解决的问题。
针对以上的核酸药物递送问题和胃癌组织靶向问题,研究团队构建了基于细胞外囊泡的工程化纳米药物递送体系,通过靶向和调控m6A表观遗传调控因子用于胃癌的治疗。细胞外囊泡是细胞产生的一种具有磷脂双分子层结构的囊泡结构,具有良好的生物相容性、低免疫原性和低毒性,被认为是药物递送的理想纳米载体。工程化修饰后的细胞外囊泡可靶向递送敲降YTHDF1表达的siRNA,并以m6A依赖的方式抑制Wnt通路受体卷曲蛋白FZD7的翻译,导致Wnt/β-catenin通路失活,进而抑制胃癌细胞的增殖和发生进展。同时研究团队还发现,肿瘤细胞的YTHDF1降低后,可介导干扰素(IFN)-γ受体1 (IFNGR1)的过表达,增强IFN-γ效应,促进肿瘤细胞主要组织相容性复合体I(MHC-I)的表达,使免疫原性肿瘤细胞直接实现自呈递,有效激活细胞免疫反应。通过表观遗传调控和免疫调节相互作用抑制胃癌的发展和转移,为胃癌治疗提供新策略。
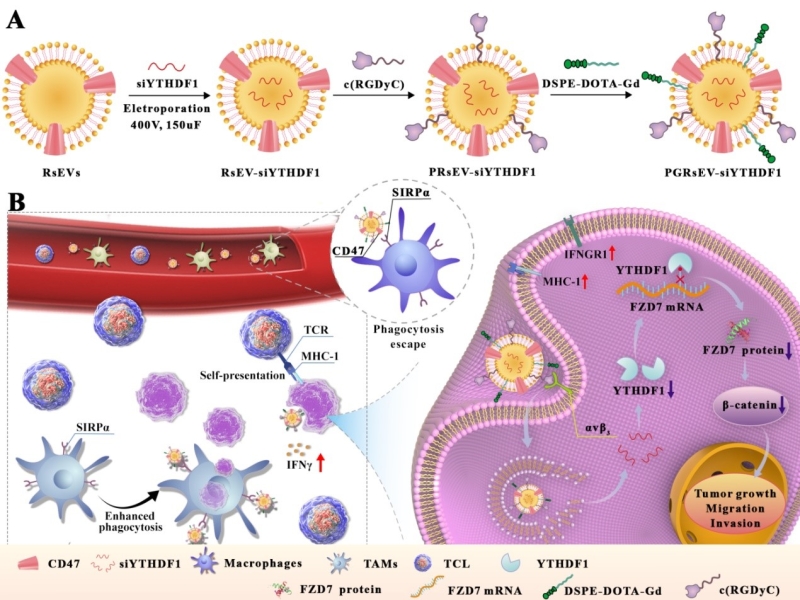
图1. 基于工程化细胞外囊泡的胃癌m6A表观遗传调控与免疫疗法示意图
国家纳米科学中心游青博士和中国医学科学院基础医学研究所王芳研究员为共同第一作者。国家纳米科学中心杨延莲研究员、朱凌项目研究员、中国医学科学院基础医学研究所余佳研究员为共同通讯作者。上述研究工作得到了中科院战略性先导科技专项、国家重点研发计划和国家自然科学基金的支持。