近日,国家纳米科学中心聂广军研究员与赵潇研究员在肿瘤细菌疗法方面取得重要进展。相关研究成果以Modular-designed engineered bacteria for precision tumor immunotherapy via spatiotemporal manipulation by magnetic field为题,发表在《自然-通讯》(Nature Communications)杂志上。
细菌疗法已成为肿瘤免疫治疗的未来发展方向之一。包括嵌合抗原T细胞(CAR-T)疗法和溶瘤病毒在内的人工生物系统疗法已取得显著的临床治疗效果,多款产品已获批上市。作为人工生物系统疗法的重要组成部分,肿瘤细菌疗法的多项II期和III期临床试验正在开展当中,有望取得下一代突破性临床进展。
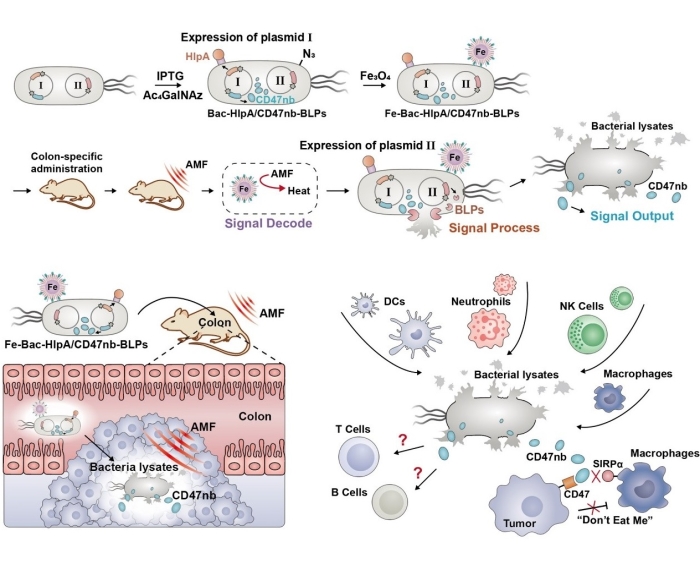
传统的第一代细菌疗法利用天然细菌发挥抗肿瘤作用,如FDA批准的治疗膀胱癌的卡介苗,虽然具有较好的治疗效果,但是细菌毒性严重阻碍细菌疗法的进一步应用。随着分子生物学技术的快速发展,第二代细菌疗法通过基因工程改造增强细菌的抗肿瘤功能、或者敲除毒力因子获得减毒细菌,极大提高其治疗效果和安全性。随着纳米技术的迅速发展,借助功能化的纳米材料辅助细菌疗法,构建“细菌-纳米材料杂合系统”,已发展成为更加安全、强效、智能的第三代细菌疗法。体内细菌基因表达的精准控制是细菌疗法安全性和有效性的基础,然而,目前仍缺少有效的精准操纵手段。
传统基因工程改造菌的诱导型启动子是控制细菌基因表达最常用的策略,然而无论是利用肿瘤微环境敏感型启动子(如缺氧、微酸响应型启动子),还是外源诱导剂响应型启动子(如阿拉伯糖响应型启动子),很难实现对体内细菌基因表达的精准操纵。近年来,近红外光已被用于基因表达操纵,然而有限的组织穿透能力限制了深部肿瘤的应用。作为理想的操纵手段,磁场具有优良的肿瘤组织穿透能力、安全性和非侵入性,但是借助传统的基因工程技术难以实现磁场对细菌基因表达的操纵。
在本工作中,研究团队借助磁性纳米材料的磁热效应,创新实现交变磁场对体内细菌基因表达和药物释放行为的时间-空间精准操纵,最终实现肿瘤的精准免疫治疗。修饰在肿瘤靶向菌表面的顺磁性Fe3O4纳米颗粒使其能够接收磁信号并将其转化为42oC热量,在热敏启动子的控制下启动裂解蛋白的表达,实现细菌的裂解和药物蛋白(抗CD47纳米抗体)的释放。同时,本工作发现并阐明工程菌裂解物的强大免疫原性能够有效激活抗原提呈细胞的I型干扰素通路,与CD47阻断疗法产生协同抗肿瘤效果,将CD47“别吃我”信号介导的天然免疫强化为CD8+ T细胞介导的适应性抗肿瘤免疫反应,对原位结肠肿瘤以及远端肿瘤产生强大的抗肿瘤作用。