



近日,国家纳米科学中心丁宝全研究员课题组在基于核酸自组装的基因沉默系统用于肿瘤治疗研究方向取得重要进展。研究成果以题为“Branched Antisense and siRNA Co-assembled Nanoplatform for Combined Gene Silencing and Tumor Therapy”发表于Angew. Chem. Int. Ed.上(DOI: 10.1021/anie.202011174),论文链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202011174 。
近年来,基因沉默系统在肿瘤治疗领域的研究已经被广泛报道,主要是通过各类阳离子脂质体,高分子聚合物和无机纳米颗粒等为载体递送反义核酸或小干扰RNA,用以沉默肿瘤相关基因,达到抑制肿瘤生长的目的。基于碱基互补配对的核酸自组装体系可被设计成具有不同尺寸和形状的纳米结构,同为核酸的各类基因治疗药物也可以通过碱基互补配对的方式进行共组装,从而使得构建基于核酸自组装的基因治疗系统成为可能。
前期工作中,丁宝全课题组在利用多功能核酸纳米结构递送基因治疗药物领域已获得一系列进展(J. Am. Chem. Soc. 2019, 141, 19032; Angew. Chem. Int. Ed. 2018, 57, 15486; Nano Lett. 2018, 18, 3328)。核酸自组装结构具有尺寸可控、可定点修饰和生物相容等特点,是一类优秀的药物载体。为进一步提高对核酸分子的利用效率,构建一类由核酸药物组成同时具有药物载体功效的基因治疗型复合纳米体系是十分具有吸引力的。
在前期研究的基础上,丁宝全课题组通过引入小分子偶联的支链核酸药物实现对反义核酸和小干扰RNA的共组装,构建一类既是载体也是药物的基因治疗型核酸纳米复合物用于对肿瘤的联合治疗。他们首先利用环形的超分子β环糊精为内核经无铜点击反应共价偶联反义核酸序列,制备支链反义核酸(7AS)。同时对经典的小干扰RNA的3’末端进行延伸,构建出一段能够同反义核酸进行部分碱基互补配对的RNA序列作为碱基识别的连接子(siRNAL)。然后,将支链反义核酸同3’末端延伸的小干扰RNA进行碱基识别并共组装得到核酸纳米复合物。通过超分子体系的主客体识别机制,在基因治疗型核酸纳米复合物中引入金刚烷修饰的靶向性叶酸配体和内涵体逃逸肽,实现对靶标细胞的选择性内化和随后的内涵体逃逸过程。在细胞内RNase H酶的识别和切割作用下,逐步释放支链反义核酸和小干扰RNA,用以对肿瘤相关基因PLK1编码的mRNA进行多位点识别和切割,实现联合的基因治疗,最终抑制肿瘤细胞的增殖。在小鼠活体水平,该类基因治疗型核酸纳米复合物表现出非常明显的肿瘤富集效果以及低免疫原性。在1.2 mg/kg的给药剂量下,观测到非常显著的对肿瘤相关基因PLK1的下调水平,最终成功抑制肿瘤的生长。该研究通过构建支链核酸药物,利用核酸自组装和超分子主客体识别,制备具有靶向识别能力和对细胞内特定生物分子产生响应的基因治疗型核酸纳米复合物,实现对靶标基因的精准治疗,为恶性肿瘤等疾病的诊疗提供新的研究策略。
论文的第一作者是国家纳米中心刘建兵副研究员,通讯作者为丁宝全研究员和刘建兵副研究员。该研究得到了国家自然科学基金和中科院战略性先导科技专项及前沿科学重点研究计划等项目的支持。
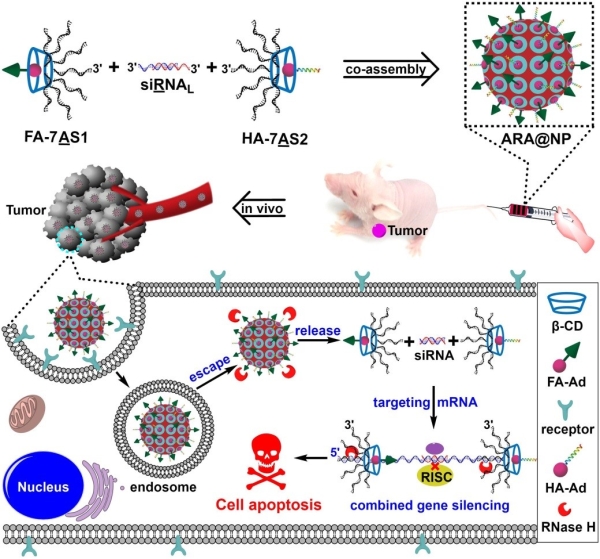
图:支链反义核酸和小干扰RNA共组装构筑的基因治疗型核酸纳米复合结构,靶向肿瘤实现肿瘤生长抑制