



肿瘤疫苗具有特异性高和毒副作用低的特点,是替代传统疗法或者辅助增强传统疗法疗效的良好选择。肿瘤疫苗作用方式主要是将肿瘤抗原递送到抗原提呈细胞,从而激活固有免疫反应和抗原特异适应性免疫反应,从而发挥系统而特异的抗肿瘤作用。尽管基于疫苗的抗肿瘤疗法有优越的理论基础,但目前仍不能达到令人满意的临床治疗效果。因此,提高疫苗的体内免疫刺激效率是肿瘤免疫治疗领域的重要研究方向之一。淋巴结是抗原提呈发生的主要场所,其中定居了大量的抗原提呈细胞,并且这些细胞毗邻于初始T细胞,在摄取抗原后能够实现快速地提呈。此外,淋巴结定居的抗原提呈细胞都是未成熟的表型,具备较强的抗原摄取能力。因此,将肿瘤疫苗有效递送至淋巴结是提高疫苗效率的重要策略之一。
基于此,国家纳米科学中心聂广军研究员和赵瑞芳副研究员构建了一种基于点击化学反应的淋巴结主动聚集的疫苗体系(Active lymph node accumulation system, ALAS),通过模拟“配体-受体”相互作用的疫苗主动靶向递送方式,促进抗原和佐剂在淋巴结中的积累,进而增强抗原呈递和T细胞激活效率。聚合物DSPE-PEG(1, 2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[amino (polyethylene glycol)]-2000)具有良好体内安全性,它与体内进行脂质运输的白蛋白具有较高的亲和性;同时,DSPE-PEG还被报道可以自发地从白蛋白中转移嵌入细胞膜的磷脂双分子层中。基于以上原理,靶标基团-叠氮(N3)被修饰到DSPE-PEG分子末端,利用白蛋白内在的淋巴结回流机制,达到叠氮分子的淋巴结定向递送和在细胞膜上插靶的目的,实现淋巴结的“点亮”;然后,表面修饰有DBCO(dibenzocyclooctyne)基团的脂质体通过点击化学反应同这些叠氮靶点进行特异性的高效反应,实现脂质体在淋巴结的积累;最终,脂质体内包裹抗原和佐剂在淋巴结内被高效共递送至抗原呈递细胞,增强肿瘤抗原特异性CD8+ T细胞反应。该研究团队在黑色素瘤皮下瘤模型和肺转移模型中验证了其良好的肿瘤抑制效果,有效延长了荷瘤小鼠的生存期。相关研究成果“Development of a Cancer Vaccine Using In Vivo Click-Chemistry-Mediated Active Lymph Node Accumulation for Improved Immunotherapy”发表于Advanced Materials(2021, DOI: 10.1002/adma.202006007)。
国家纳米科学中心博士研究生覃好和副研究员赵瑞芳为该文章的共同第一作者,赵瑞芳副研究员和聂广军研究员为共同通讯作者。上述工作得到了国家基础研究计划,中科院战略性先导科技专项(B类),国家自然科学基金,黄国强教育基金会等项目的支持。
原文链接: https://onlinelibrary.wiley.com/doi/10.1002/adma.202006007。
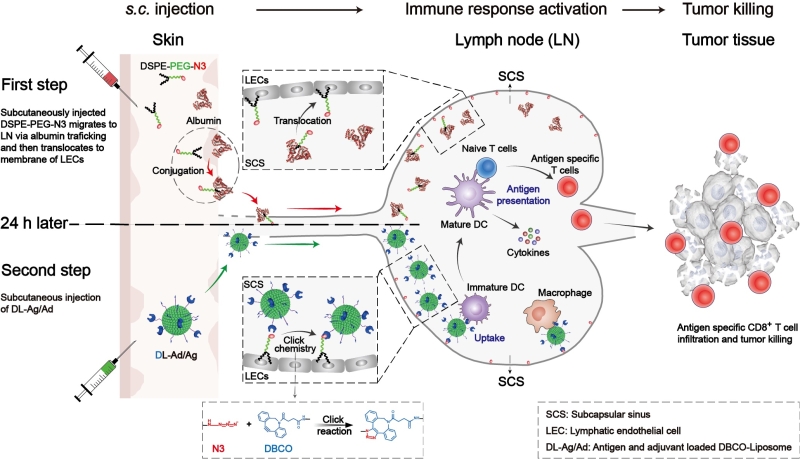
图. 淋巴结主动聚集纳米疫苗的工作原理