



近日,国家纳米科学中心陈春英研究组和杨蓉研究组在单原子纳米酶用于肿瘤催化治疗方面取得重要进展。相关研究成果以Tumor-Microenvironment- Responsive Cascade Reactions by a Cobalt-Single-Atom Nanozyme for Synergistic Nanocatalytic Chemotherapy为题,发表于《德国应用化学》(Angewandte Chemie International Edition, 2022,61, e202204502)。
近年来,基于肿瘤微环境(TME)响应产生活性氧(ROS)的纳米催化疗法受到广泛关注。然而,纳米材料模拟酶(简称纳米酶)有着多种表面构象和晶体结构,以及不均一的元素分布,因而衍生出复杂的催化机制,对提升其类酶活性和特异性带来重大挑战。如何合理设计和有效模拟生物酶的活性位点和空间构象,仍然是一个非常关键而极具挑战性的研究方向。
单原子纳米酶是新近发展起来的一类纳米酶,具有可设计的几何结构和电子配位、独特的量子尺寸效应和最大限度的原子利用效率,为桥连纳米酶和天然酶创造了重要机遇。受天然酶结构启发,人们通过模拟其金属-Nx活性单元,陆续开发出一些仿生单原子纳米酶。其中,以TME过表达的H2O2为反应底物,这些单原子纳米酶通过芬顿反应可产生羟基自由基等活性氧物种。然而,由于肿瘤组织H2O2浓度有限,迫切需要探索高效产生ROS的新型化学反应路径。
Co是一种人体不可或缺的微量元素,广泛存在于维生素B12(钴胺素),该中心Co离子与四吡咯咕啉环配位,具有参与制造骨髓红细胞、防止恶性贫血和保护大脑神经系统等功能。国家纳米科学中心陈春英研究员、杨蓉研究员和蔡双飞副研究员等人合作研发了一种通过Co单原子纳米酶启动级联酶促反应进行肿瘤催化治疗的新策略。这种纳米酶由氮掺杂的多孔碳负载Co单原子(Co-SAs@NC)组成,有着比表面积大、高度分散的原子位点和Co-N配位结构等优势。在级联催化反应中,它首先发挥类似过氧化氢酶(CAT)活性,将肿瘤细胞内源性H2O2分解产生O2,随后表现类氧化酶(OD)活性,将O2还原成超氧阴离子(O2•−)自由基,引发肿瘤细胞凋亡。进一步与化疗药物(阿霉素)联用,显著增强了抗肿瘤效果。
该材料通过配位-热解-腐蚀过程制备得到,并用球差电镜、同步辐射等表征技术证实了其单原子结构。Co-SAs@NC显示出高效的类CAT活性,其分解H2O2产生O2的表观活化能由Arrhenius方程测定为34.1 kJ mol-1,低于氮掺杂的多孔碳负载的Co纳米颗粒(43.1 kJ mol-1)、过氧化氢酶(46.4 kJ mol-1)和H2O2热分解需要的能量(210 kJ mol-1)。同时,其具有较宽的温度使用范围(30-75 oC)和可回用能力。通过米氏方程考察其稳态动力学,发现其催化常数(kw)高于很多已知的CAT模拟酶。更为独特的是,在级联催化反应中,Co-SAs@NC能有效激活类似CAT催化所生成的O2而发生类似OD催化,导致产生O2•−作为关键活性氧物种,同时可抑制类似过氧化物酶(POD)活性。DFT计算结果表明,O2比H2O2在Co-N4位点有更低的吸附能(-0.81 eV vs. -0.32 eV),这种优先的O2吸附及其活化造成O-O键长拉伸(从1.20Å到1.29Å),最终使得材料对OD催化表现出出色的特异性。稳态动力学研究结果显示,其类OD活性高于很多单原子纳米酶和传统纳米酶。
细胞毒性实验、ROS荧光、流式细胞术等实验结果表明,Co-SAs@NC在pH=6.0的酸性环境下,由级联反应产生大量的O2•−自由基,联用阿霉素后,这种协同的纳米催化化疗对小鼠乳腺癌生长表现出了显著的抑制效果(92%)。HE染色和小鼠生化指标测试结果显示,主要组织器官没有明显损伤, Co-SAs@NC表现出良好的生物相容性。实验结果表明基于Co单原子纳米酶的纳米催化化疗是一种很有前途的肿瘤治疗策略。
国家纳米科学中心蔡双飞副研究员和北卡罗来纳州立大学刘佳明博士为该文章的共同第一作者,陈春英研究员、杨蓉研究员和蔡双飞副研究员为共同通讯作者。上述研究工作得到了中国科学院战略性先导计划、国家重点研发计划、国家自然科学基金、广东省重点研发计划、广东高水平创新研究机构等项目的支持。
原文链接: https://onlinelibrary.wiley.com/doi/10.1002/anie.202204502
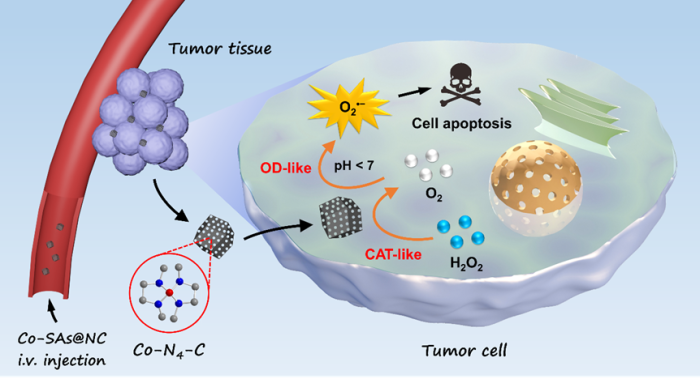
图. Co-SAs@NC启动肿瘤微环境响应的级联反应用于肿瘤催化治疗