



近日,国家纳米科学中心陈春英院士团队在聚乳酸微塑料作为碳源进入体内碳循环方面取得重要进展。相关研究成果以“Incorporation of polylactic acid microplastics into the carbon cycle as carbon source to remodel the endogenous metabolism of the gut”为题,发表在《美国国家科学院院刊》(Proceedings of the National Academy of Sciences of the United States of America, 2025, 122, e2417104122)。
微塑料污染是全球面临的严重生态环境问题,也是影响人体健康的重要风险因素。在传统“限塑令”难以突破石油基塑料污染困局的背景下,聚乳酸(PLA)——FDA认证的医用可降解材料,作为战略替代材料的核心价值日益凸显。然而,PLA虽已在食品包装领域实现规模化应用,却隐藏着潜在风险:其脆性特质使其更易生成微塑料颗粒。这些颗粒能够高效入侵机体肠道系统,并在菌群-宿主界面触发未知的生物转化过程,影响其最终命运。因此,精准解析PLA微塑料在机体内的转化图谱对于评估其安全性至关重要。
在本工作中,研究团队聚焦PLA微塑料(PLA-MPs)的体内转化展开系统研究。通过空间功能分析,发现结肠微生物是PLA-MPs降解的核心功能单元,其分泌的特异性酯酶FrsA通过α/β水解结构域精准识别并切割PLA酯键,实现对PLA-MPs的高效降解。进一步,通过多组学分析,研究人员发现了微生物组成和FrsA蛋白表达之间的相关性,结合菌群-蛋白互作网络与单菌功能验证,证实鼷鼠螺杆菌与居肠巴恩斯氏菌主导PLA-MPs的肠道降解进程,为靶向调控塑料生物转化提供关键靶点。
在阐明降解机制的基础上,团队创新性构建稳定同位素13C标记与代谢流示踪联用技术,成功突破内源代谢物-外源颗粒衍生物信号解耦的方法学瓶颈,首次揭示PLA微塑料可作为碳源进入肠道微生物及肠上皮的双重“碳循环”(图1),并通过碳循环路径整合至微生物-宿主共代谢网络:在微生物层面,13C标记的PLA-MPs经乳酸、天冬氨酸等中间体进入嘌呤代谢轴,驱动肠道特征代谢物尿酸的生物合成(13C-PLA-MPs—13C-Lactate—13C-Aspartate—13C-Xanthine—13C-Urate);而在肠上皮层面,13C-PLA-MPs则通过琥珀酸代谢枢纽参与氨基酸及核苷酸前体的合成代谢。PLA-MPs进入肠道碳循环的过程最终引发肠道内源代谢重编程,其通过降低短链脂肪酸生成、扰乱能量代谢稳态及碳通量再分配,导致宿主摄食行为抑制与体重显著下降。
本研究通过多维度方法学整合(稳定同位素示踪-代谢流分析-宏基因组/蛋白质组-理论模拟),实现了从PLA微塑料降解分子机制(源头)、碳循环网络重构(过程)到代谢表型调控(终端)的全链条解析,完整绘制出生物可降解微塑料在哺乳动物体内的动态生物转化图谱。该研究对评估可降解材料或生物医用材料的生物安全性具有重要价值,为理解外源颗粒对机体生命过程的影响提供了关键数据支持。
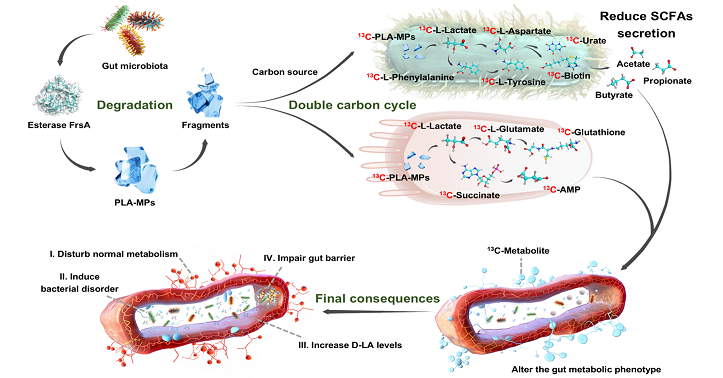
图1. PLA微塑料作为碳源进入肠道微生物和肠上皮的双重“碳循环”
国家纳米科学中心鲍琳博士为本文的第一作者,崔雪晶副研究员、陈春英院士为本文的通讯作者。哥伦比亚大学Kam W. Leong院士为本文合作者。上述研究工作获得了国家重点研发计划、新基石研究员项目、基础科学中心项目、国家自然科学基金、北京市科技新星、中国科学院青促会等项目的支持。
原文链接:https://www.pnas.org/doi/10.1073/pnas.2417104122