



在肿瘤免疫治疗领域,免疫检查点抑制剂在错配修复功能完整(pMMR)的结直肠癌(CRC)等“免疫冷肿瘤”中疗效受限,其核心障碍在于其抑制性肿瘤微环境肿瘤相关抗原呈递和T细胞浸润的缺乏及免疫抑制性信号通路的活跃。为解决这一难题,国家纳米科学中心王浩研究员联合新桥医院等研究团队,开创性地研发了聚合物-多肽基智能形变材料。该体系能够响应肿瘤微环境(pH=6.5-6.8)特征,实现从纳米颗粒至纳米纤维的原位动态形貌转换,通过物理性破坏肿瘤细胞膜诱导免疫原性细胞死亡,从而高效逆转免疫抑制微环境,为结直肠癌的免疫治疗提供了全新的范式。相关成果以“Nanorobots Hold PD-L1 and Break Membrane of Colorectal Cancer Cells for Immunotherapy” 为题,发表于《自然-纳米技术》。
结直肠癌作为高发恶性肿瘤,约95%患者属于“错配修复功能完整型冷肿瘤”,具有高度免疫抑制的微环境,其特征为细胞毒性T淋巴细胞浸润缺失及PD-1/PD-L1检查点通路的上调,导致对免疫检查点抑制剂的原发性耐药。现行的“增热”策略,如化疗、放疗及光热疗法,旨在通过诱导免疫原性细胞死亡来释放损伤相关分子模式(DAMPs,如HMGB1、CRT和ATP等),从而启动抗肿瘤免疫应答。然而,这些方法因其非特异性靶向分布,常伴随严重的脱靶效应,例如骨髓抑制及免疫相关不良事件,限制了其治疗窗口。
本研究设计的聚合物-多肽纳米药物展现了多步级联的精准作用机制,实现精准靶向与酸响应原位自组装驱动的物理免疫治疗。(1) 主动靶向与初始定位:表面功能化的PD-L1靶向配体,可介导其特异性识别并高亲和力结合于肿瘤细胞膜表面的PD-L1,实现药物在靶点的富集;(2)微环境响应性构象转换:抵达肿瘤组织后,感知弱酸性肿瘤微环境pH值,触发聚合物-多肽结构的亲疏水性平衡改变,发生原位变构。此动态过程驱动纳米颗粒在细胞膜表面重构并延展为致密的纳米纤维网络;(3)物理性膜扰动与免疫原性细胞死亡诱导:此纳米尺度的形貌转变施加了显著的物理应力,直接扰动并破坏肿瘤细胞膜的完整性。 这种膜损伤导致胞内DAMPs(如ATP、HMGB1释放和CRT易位)的大量释放,从而高效招募并激活抗原呈递细胞及T细胞;(4)免疫检查点阻断协同增效:通过站位PD-L1,在局部实现了高效的PD-1/PD-L1信号通路阻断,解除了对浸润T细胞的抑制,协同免疫原性细胞死亡产生的肿瘤抗原,实现了对“冷”肿瘤微环境的系统性重塑。
该系统在多种结直肠癌小鼠模型(包括dMMR型、pMMR型)中展现出优异的抗肿瘤效果。实现了超过120小时的长效肿瘤内滞留,确保了持续的药物暴露,为持续发挥PD-L1阻断治疗提供了保障。肿瘤内CD8⁺ T细胞与CD4⁺ T细胞的浸润显著增加,成功将“免疫冷”表型转化为“免疫热”表型。与临床标准ICI单药或联合化疗方案相比,该系统产生了更为强大且持久的抗肿瘤效应。在治疗期间未观察到显著的系统性毒性反应,展现了优越的安全性特征。深入的机制研究进一步证实,膜损伤生物标志物的出现以及经典的ICD信号通路激活是免疫杀伤起效的关键。尤为重要的是,研究揭示其疗效根源在于“动态”的多肽聚合物纤维原位生成过程,而非预先构建的静态纤维结构。
此项研究不仅为pMMR结直肠癌患者临床治疗难题提供了一种极具前景的治疗策略,更展示了刺激响应性原位自组装纳米技术在精准物理免疫治疗领域的巨大潜力。该平台技术具有高度的通用性,为攻克其他类型的免疫抑制性实体瘤开辟了新路径。研究团队后续将重点推进其全面的临床前药代动力学与毒理学研究,并拓展其在更多难治性实体瘤模型中的疗效验证,为最终的临床转化铺平道路。
新桥医院应望硕士和郑传浩硕士为论文共同第一作者,国家纳米科学中心王浩研究员、新桥医院杨仕明主任、罗强副研究员、加拿大曼尼托巴大学邢孟秋教授为本文共同通讯作者。该论文得到了国家自然科学基金、重庆市医学科学项目(重庆市卫健委)和重庆市自然科学基金等项目的资助。
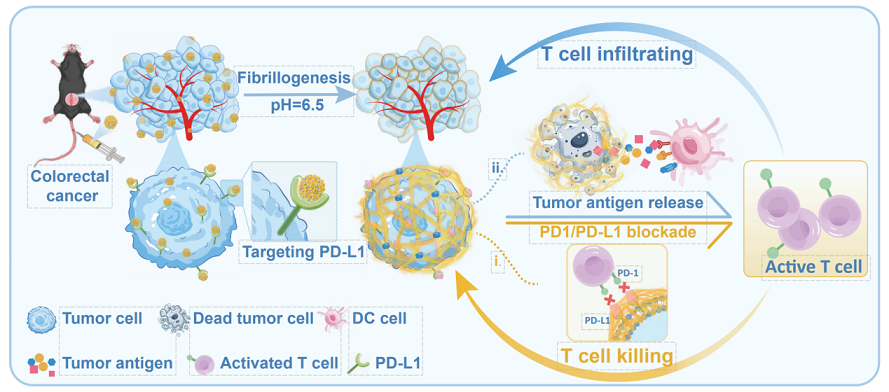
聚合物-多肽靶向变构纳米药物“加热”冷结直肠肿瘤的机制示意图
论文链接:https://www.nature.com/articles/s41565-025-02071-3