



近日,国家纳米科学中心梁兴杰研究团队报道了一种基于可变形巨噬细胞纳米激活剂(Bacterial-targeted transformation macrophage nanorejuvenator,BATMAN)的脓毒症相关继发感染防治新策略。该研究通过协同调控病原体清除与受损免疫功能修复,为破解脓毒症进程中“感染难控制、免疫难修复”的核心难题提供了新思路,并为继发感染的精准干预与转化应用奠定了重要基础。相关成果以“FcγR-targeted tuftsin clusters rejuvenate macrophages in preclinical sepsis-associated secondary infection”为题,发表于《科学转化医学》(Science Translational Medicine)。
脓毒症引起的免疫功能障碍使患者容易遭受致命继发感染威胁,给临床治疗带来沉重负担。尽管抗生素仍是临床治疗的首选方案,但越来越多的研究表明,脓毒症期间以巨噬细胞抗菌功能损伤为代表的长期免疫抑制与患者不利的抗菌结局密切相关,表明单一抗菌疗法无法从根本上消除继发感染隐患。在实现有效感染控制的同时修复受损免疫功能,仍是脓毒症治疗领域面临的核心挑战。在此背景下,能够增强巨噬细胞抗菌功能的免疫调节分子受到关注。促吞噬肽(Tuftsin)是一种源自免疫球蛋白G的内源性四肽,已被证实可增强巨噬细胞的吞噬与抗菌能力。然而其短肽结构易被快速吞噬清除和蛋白酶降解,严重限制其体内应用。如何实现Tuftsin对脓毒症中功能异常巨噬细胞的稳定、精准递送,成为提升宿主抗菌防御能力的一项关键挑战。
针对上述挑战,研究团队开发了一种细菌靶向的可变形巨噬细胞纳米激活剂(命名为BATMAN),旨在通过协同抑制细菌侵袭和修复巨噬细胞及机体的抗感染免疫防御实现对脓毒症相关继发感染的治疗。该纳米激活剂由细菌靶向肽(UBI29−41)、细菌脂肪酶敏感型胆固醇琥珀酸单酯修饰的赖氨酸(K(Chems))、驱动组装的β-淀粉样蛋白衍生肽(FFVLK)和免疫球蛋白G衍生的Tuftsin肽组成的可变形多肽经自组装形成。
实验结果显示,经静脉输注的BATMAN能有效富集在脓毒症小鼠的感染肺部,并特异性结合在细菌表面。随后,在细菌脂肪酶酶解作用下,BATMAN脱去疏水核心Chems,触发FFVLK驱动的形变和再组装。该二次组装过程导致原本隐藏在BATMAN内部的Tuftsin得以暴露,并在细菌表面形成簇状结构,进而促进其与巨噬细胞Fcγ受体的相互作用。该过程不仅能增强巨噬细胞吞噬细菌的能力,还能重塑其抗菌表型,实现抗菌功能修复。同时,形变后的纳米结构还能有效锚定在细菌表面,进而降低细菌的侵袭性。
在由多类致病菌引起的肺部继发感染脓毒症小鼠模型中,BATMAN治疗相较于抗生素疗法显著提高了小鼠的存活率,并促进其肺部及全身抗菌防御功能恢复。这种兼具细菌侵袭性抑制和免疫功能调节的巨噬细胞纳米激活剂突破了传统仅“清除细菌”的治疗思路,为脓毒症相关继发感染的治疗提供了一种全新策略,也为未来开发更多免疫调控型抗感染材料奠定了基础。
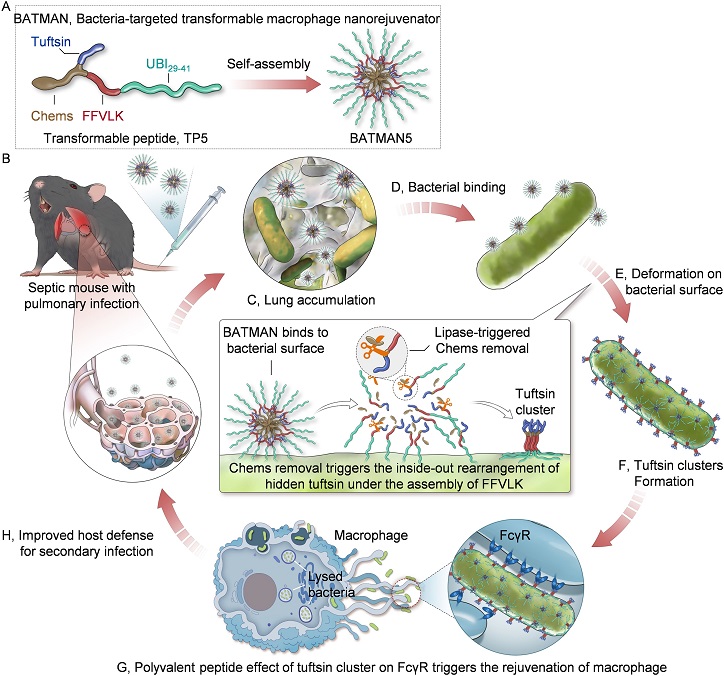
图1. 基于可变形巨噬细胞纳米激活剂的脓毒症相关继发感染防治新策略
国家纳米科学中心卿光超博士和张宇轩博士为本文的共同第一作者,国家纳米科学中心梁兴杰研究员和重庆大学/重庆市人民医院罗阳教授为本文共同通讯作者。上述研究工作得到国家重点研发计划、国家自然科学基金、国家科技重大专项等项目的支持。
原文链接:https://www.science.org/doi/10.1126/scitranslmed.adv0313